Waterstofwolken, Zwaveldampen, Helium, Diamant is een koolstof, Zuurstofbubbels, Vloeibare stikstof, Zonnevlammen.
Inhoudsopgave
Quark-gluon-plasma in het vroege universum
Video: Animation of stellar nucleosyntheses
Video: Crab nebula supernova explosion
Periodiek Systeem der Elementen
Hoe is het Periodiek Systeem opgebouwd?
Hoofd-en-subniveaus in een elektonenwolk
Video: The Magical Leaf The Quantum Mechanics Of Photosynthesis

Quark-gluon-plasma in het vroege universum creëert een magnetisch veld.
Hot-quark-soup-produced-at-rhic.
Een plasma heeft veel weg van een gas of bij hoge dichtheid van een vloeistof: de deeltjes die het plasma vormen kunnen net als in gassen en vloeistoffen ongeordend door elkaar bewegen. Het grote verschil met gassen en vloeistoffen is dat in een plasma ook de ladingen van de deeltjes vrij door elkaar heen bewegen. In een gas zijn het altijd hele, ongeladen atomen of moleculen die bewegen. In een plasma zijn de bouwstenen opgebroken in hun geladen componenten (bijvoorbeeld in losse elektronen en atoomkernen), en bewegen ook die geladen componenten vrij door elkaar. Vreemd genoeg leek het eerder een vloeistof dan het verwachte hete gas.
Het universum bestond op zijn eerste momenten uit een perfecte vloeistof. Wetenschappers hebben vijf jaar lang gezocht naar het quark-gluonplasma waarvan wordt gedacht dat het ons heelal heeft gevuld in de eerste microseconden van zijn bestaan.
Quarks zijn de bouwstenen van protonen en neutronen. Gluonen dragen de sterke kracht die protonen en neutronen met elkaar verbindt. Er wordt aangenomen dat deze deeltjes na de aanvankelijk intense hitte enige tijd nodig hadden om tot gewone materie te condenseren. Om deze soep van ongebonden deeltjes na te bootsen, versnelt de RHIC (Relativistische Heavy Ion Collider), geladen goudatomen in de buurt van de lichtsnelheid voordat ze samen worden gebroken. Eerdere experimenten hebben aangetoond dat deze botsingen iets creëren dat twee biljoen graden Celsius bereikt: ongeveer 150.000 keer heter dan het centrum van de Zon.
Quarks en gluonen zijn deeltjes met "kleurlading. Net zoals elektrisch geladen deeltjes elkaar beïnvloeden door het uitwisselen van fotonen, zo is er bij "gekleurde" deeltjes de sterke kernkracht voor het uitwisselen van gluonen. Hierbij worden ze vaak aan elkaar "gelijmd".
Van die ‘kleuren’ bestaan drie soorten, die elkaar samen opheffen, zoals positief + en negatief – dat doen bij de elektrische lading. Gekozen is daarom voor de naam kleur-lading, met als soortnamen "rood", "groen" en "blauw" (samen "wit").

Wanneer geladen deeltjes in deze quark-gluon-plasma bewegen, creëren ze een magnetisch veld, waardoor een netwerk van ‘spinning quarks and gluons’ ontstaat. Voor deeltjes is de richting van de spin een belangrijke beschrijving van het impulsmoment.
Behoud van impulsmoment bij kunstschaatsers: Als een kunstschaatser een pirouette maakt, zie je vaak dat de draaiing wordt ingezet met wijd uitgestrekte armen. Als de schaatser de armen intrekt wordt de draaiing enorm versneld. Dat is een direct gevolg van het behoud van impulsmoment: de afstand van de armen tot het midden wordt steeds kleiner, dus de snelheid wordt groter.
Het impulsmoment is een "hoeveelheid draaiing": een draai-impuls. Impuls is de "hoeveelheid beweging" gerelateerd aan de snelheid en de massa, in het Engels: momentum.
Dit momentum wordt ondervonden wanneer dergelijke minuscule en grotere objecten doorheen een magneetveld bewegen en een magneetveld creëren. Het momentum geeft een maat van sterkte en de oriëntatie aan van de magnetische noord- of zuidpool dat het in dat veld veroorzaakt.
De meest elementaire deeltjes van het vroege universum:
Protonen en neutronen zijn opgebouwd uit quarks, die samen met elektronen de elementaire bouwstenen zijn van alle materie.
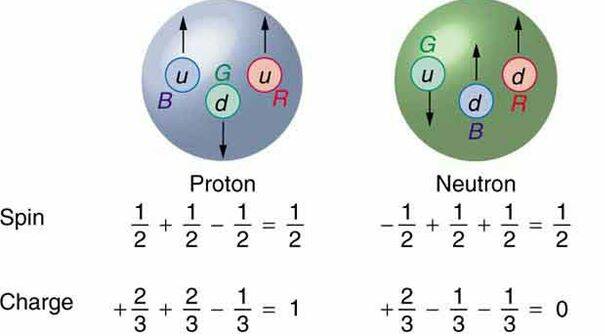
Zowel elektronen als quarks hebben eigenschappen die we spin noemen.

Elektronen kunnen maar op twee manieren "rondtollen": Spin up en Spin down. Dit is Spin ½ a 'double-rotation'.
Spin ½ betekent dat het deeltje twee keer volledig moet worden gedraaid, zie animatie hieronder.

'Spin' betekent eigenlijk rotatie, maar heeft in deze betekenis niets te maken met een daadwerkelijke draaiing van een deeltje om zijn as. Een enkel punt in de ruimte kan continu draaien zonder verstrikt te raken. Na een rotatie van 360 ° keert de spiraal terug naar zijn oorspronkelijke stand en voltooid daarna een volledige 720 ° en maakt dus een 'double rotation'
Zie ook Spinor voor een scherpe visualisering om spinning voor te kunnen stellen.
Spin is een magnetische richting van een elementair deeltje. Het is een kwantummechanische eigenschap, die op geen enkele wijze met de klassieke mechanica is te beschrijven. Een magnetisch moment wordt ondervonden door lussen van elektrische stroom zoals in elektro- en permanente magneten, elementaire deeltjes, diverse moleculen én zelfs in planeten, manen en sterren.
Waterstof en helium zijn de twee lichtste en tevens de allereerste atomen, die het hele stellaire proces in gang hebben gezet. De allereerste sterren vormden zich doordat wolken van vrijwel puur waterstof en helium onder hun eigen zwaartekracht inklapten. 200 miljoen jaar later kwam nucleosynthese opgang. Het proces waarbij kernen van zwaardere elementen, bestaande uit protonen en neutronen, worden opgebouwd uit lichtere elementen. De stellaire nucleosynthese vindt plaats in de kern van sterren.

De supernovae nucleosynthese, vele honderden miljoenen jaren later, zegt iets over de vorming van elementen tijdens de explosies van supernova's. Zeer zware sterren die na de ijzerverbranding exploderen in een Supernova, kunnen nog zwaardere elementen vormen. Vooral in het R-proces (de R van ‘rapid’) waarbij heel snel neutronen worden ingevangen. Dit proces is verantwoordelijk voor het creëren van ongeveer de helft van atoomkernen zwaarder dan ijzer.
Het toevoegen van neutronen aan een kern kan de kern stabieler maken. Een kern met meer dan één proton is alleen stabiel als er voldoende neutronen aanwezig zijn. Het is echter niet zo dat een groter aantal neutronen altijd stabiliserend werkt; bij een te groot aantal neutronen wordt de kern ook instabiel. Neutronenvangst resulteert dan in een nieuwe, stabiele isotoop van het atoom, dus met meerdere neutronen. Maar het kan ook leiden tot het ontstaan van radioactieve isotopen, met een onstabiele atoomkern die door radioactief verval overgaan in andere elementen, of andere isotopen.
Bij het β−-verval wordt een neutron in een proton omgezet: het atoomnummer wordt dan met één verhoogd en er ontstaat dus een ander element.
Op 17 februari 1869 laat een jonge Russische chemicus van de universiteit van Sint Petersburg tweehonderd kopieën maken van een artikel dat hij onder vakgenoten wil verspreiden. ‘Een poging tot een systeem van de elementen’, heeft Dmitri Ivanovitsj Mendelejev boven het vel papier gezet.

Metalen en niet-metalen

Groepen en Perioden
Groepen: Een verticale kolom van elementen die verwante eigenschappen vertonen. Er zijn in totaal 18 groepen.
Perioden: Een horizontale rij van elementen met toenemend atoomnummer. Er zijn in totaal 7 periodes.
Alle elementen zijn gerangschikt naar opklimmend atoomnummer.
Het atoomnummer geeft het aantal protonen in de kern van het atoom aan. Wanneer het atoom als geheel elektrisch neutraal is, is het atoomnummer gelijk aan het aantal elektronen in de elektronenwolk rond de kern. Juist die elektronen bepalen het chemische gedrag van een atoom. Atomen met hetzelfde atoomnummer maar verschillende massagetallen zijn isotopen.
Het massagetal is de som van het aantal protonen en neutronen in een atoomkern. De meeste atomen kunnen meerdere massagetallen hebben. Dit wordt veroorzaakt door het feit dat het aantal neutronen in de kern kan variëren. Het aantal protonen in een bepaald atoom is echter altijd hetzelfde.
De atomaire massa-eenheid aangeduid als u van het Engelse atomic mass unit, is gedefinieerd als 1/12 van de massa van één koolstof-12 atoom = = 1,993 × 10−23 g
Elektronen in de buitenste regionen van de wolk, bepalen voornamelijk de scheikundige eigenschappen van de atomen. Elektronen zoeken hun eigen welbepaald plekje om de atoomkern.

Elektronenwolk met orbitalen. Een orbitaal is de baan waarin 'n elektron met een bepaalde energie zich met 90% waarschijnlijkheid bevindt.
Het woord 'baan' is 'n beetje misleidend, omdat het elektron zich ook als een golf gedraagt. Toch is het handig om van 'banen' te spreken. Voor iedere golvende baan beschrijft een wiskundige formule de waarschijnlijkheid om het elektron ergens aan te treffen. Elke baan heeft een bepaald energieniveau ten opzichte van de kern en worden van binnenuit het eerst opgevuld.
In het algemeen geldt: hoe verder van de kern, hoe hoger het energieniveau, maar de elektronen beïnvloeden ook elkaar omdat zij geladen deeltjes zijn. Bron: Aljevragen.nl
Erwin Schrödinger, een Oostenrijkse natuurkundige, beschreef de beweging van elektronen met golvingen in de elektronenwolk.
Instead of being organized in Bohr’s 2-D orbits, electrons are actually found in 3-D orbitals. Each orbital defines an area where the probability of finding an electron is high. These orbitals are known as electron “clouds”

Hoofd-en-subniveaus in een elektonenwolk
Bron: Aljevragen.nl
Elektronen bevinden zich zoals we zagen in een elektronenwolk rond de atoomkern, maar bewegen niet willekeurig door de elektronenwolk. Ze zijn verdeeld over een aantal schillen, dit zijn energieniveaus. De verdeling van de elektronen van een bepaald atoom over de beschikbare energieniveaus noemt men de elektronenconfiguratie. Er zijn 2 soorten energieniveaus: hoofdniveaus en subniveaus.
Hoofdniveau
Het aantal elektronen dat zich maximaal op een hoofdniveau kan bevinden, staat weergegeven in onderstaande tabel:
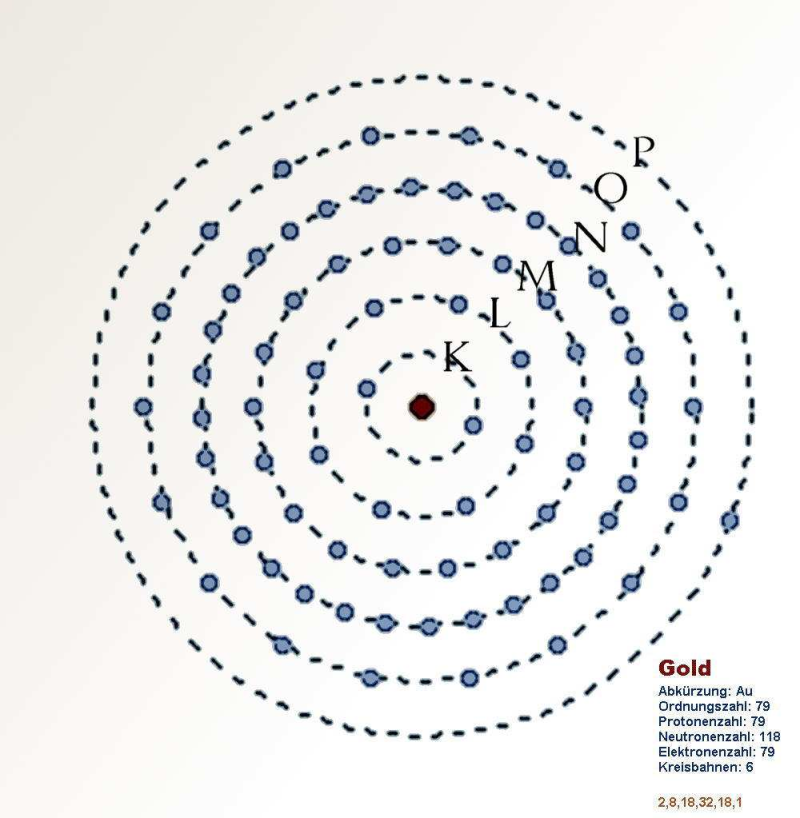

We onderscheiden 7 hoofdschillen, K-L-M-N-O-P-Q. Hun kenmerk is het hoofdkwantumgetal n. Ze worden genummerd van 1 (overeenkomend met K) tot 7 (overeenkomend met Q). Er geldt dat hoe hoger de waarde van n is, des te groter is de energie van de schil m.a.w. hoe verder een elektron verwijderd is van de kern, dus in een hogere schil, des te meer energie heeft het elektron. Het elektron wordt aangeslagen. In die hogere schil is dat elektron echter instabiel: het wil rust, het wil naar een staat van minimum energie! Dus het elektron wil de reis terug maken naar een lagere schil, en het te veel aan energie raakt het elektron kwijt door het uitzenden van een foton met precies dezelfde energie, en er ontstaat licht!
Licht ontstaat doordat atomen aangeslagen worden. Het elektron, in dit geval, van een waterstofatoom cirkelt in een baan dicht om de kern (1). Als het atoom botst met een vrij elektron afkomstig van de zon (2 en 3), dan schiet het elektron in een hogere baan rondom de kern: het atoom is aangeslagen (4). De energie die bij de botsing wordt overgedragen bepaalt in welke baan het elektron schiet: hoe meer energieoverdracht, hoe hoger de baan.
De aangeslagen toestand duurt zéér kort, een honderdmiljoenste seconde. Het atoom ‘valt’ daarna terug naar de grondtoestand. De energie die vrijkomt bij dit terugvallen wordt uitgezonden in de vorm van een foton, een lichtdeeltje (5). De golflengte van dit licht (en dus de kleur) is afhankelijk van de hoeveelheid energie die vrijkomt. Hoe meer energie, hoe korter de golflengte van het uitgezonden licht.
Subniveau
Met uitzondering van hoofdniveau 1 zijn alle andere hoofdniveaus onderverdeeld in verschillende subniveaus. Deze subniveaus (subschillen) worden aangeduid met de letters s, p, d en f. Hoeveel elektronen een subniveau maximaal kan bevatten staat weergegeven in onderstaande tabel:

Om de orbitalen per element te kunnen volgen open je het Dynamisch Periodiek Systeem #Orbital
Met de muisbeweging kun je bij elk element de opvulling zien van de subniveaus, aangegeven met pijltjes.
Elektronegativiteit is de mate hoe sterk een atoom elektronen aantrekt. Hoe groter de elektronegativiteit, hoe sterker een atoom elektronen aantrekt. Door ’n hoge elektronegativiteit binden niet-metalen hun elektronen heel sterk aan de kern. M.a.w. ze staan niet gemakkelijk een elektron af en zijn daardoor sterke oxidatoren, die gemakkelijk een elektron opnemen. Stoffen die elektronen gemakkelijk afstaat zijn reductoren. Een reactie tussen atomen, moleculen en/of ionen waarbij elektronen worden uitgewisseld, wordt een redoxreactie genoemd, een samenstelling van de begrippen reductie en oxidatie.
Valentie-elektronen zijn cruciaal bij chemische bindingen tussen atomen. Het aantal valentie-elektronen bepaalt de bindingsmogelijkheden van een atoom. Deze bevinden zich in de buitenste ‘banen’ of beter: de buitenste ‘regionen’ en worden daarom makkelijk afgestaan om een verbinding aan te gaan.

Alle atomen uit groep 1 hebben één valentie-elektron en alle atomen uit groep 2 twee valentie-elektronen. Uit groep 13 hebben er drie en uit groep 14 vier enz.
Een valentiebinding komt voort uit de regel dat het centrale atoom in een molecuul de voorkeur geeft aan het vormen van elektronenparen. Met het begrip 'valentie' wordt het maximale aantal atomen aangegeven, dat een chemische verbinding kan aangaan met een gegeven ander atoom.

Met de term elektronenpaar wordt verwezen naar een paar elektronen in de buitenste schil dat niet voor een valentiebinding gebruikt wordt. Elektronenparen horen bij het betreffende atoom, maar kunnen een tijdelijke band met een ander deeltje vormen. In dat laatste verband wordt ook vaak gesproken van een vrij elektronenpaar.
Zoals aangegeven vindt er stellaire nucleosynthese plaats in de kern van sterren.
De druk en temperatuur binnenin een ster lopen enorm hoog op zodat waterstofkernen met elkaar versmelten, ze fuseren. Waterstof wordt omgezet in helium. De druk en temperatuur in de kern zijn afhankelijk van de massa van de ster: hoe groter zijn massa, des te sneller de waterstof opraakt.
Naarmate het helium opraakt, zakt de kern in en stijgen temperatuur en druk weer. Daarna begint het helium in de kern tot koolstof te fuseren. Het fusieproces zet zich voort: steeds zwaardere elementen worden in de kern van de ster gevormd. Fusies vinden plaats op de grenzen tussen de lagen, als de schillen van een ui.
Na koolstof is neon aan de beurt, dan zuurstof en uiteindelijk silicium. Bij de siliciumfusies wordt er radioactief nikkel gevormd, dat snel tot ijzer vervalt. Uiteindelijk bestaat de kern van een zware ster alleen nog maar uit massief ijzer. Ten slotte implodeert de kern, waarna de ster explodeert en eindigt als een supernova.
Enkele elementen ga ik nader toelichten omdat ze elementair zijn voor het ontstaan van het aardse leven.

Atoommassa waterstof 1,0079u (unit)
De atomic mass unit is gedefinieerd als 1/12 van de massa van één koolstof-12 atoom = 1,993 × 10−23 g
Elektronenconfiguratie: 1 valentie elektron // Orbitaal 1s1
Waterstof is het meest eenvoudige element met slechts één proton en één elektron en is daarmee het meest voorkomende element in het universum. In 1766 werd door de Engelse chemicus en natuurkundige Henry Cavendish bewezen dat water een verbinding is van waterstof en zuurstof, toen hij experimenten uitvoerde met kwik. Hij vermoedde dat het metaal de bron van het gas kon zijn. Daarom noemde hij zijn nieuw ontdekte element brandbaar gas van metalen. Enkele jaren later gaf Antoine Lavoisier waterstof de huidige Latijnse naam hydrogenium.
Onder atmosferische omstandigheden vormt waterstof een twee-atomig molecule: diwaterstof = moleculaire waterstof (H2) dat meestal gewoon als waterstof of waterstofgas aangeduid wordt.
Onder extreem hoge druk, bijvoorbeeld in gasreuzen zoals de planeten Jupiter en Saturnus, komt metallische waterstof voor. Dit komt doordat de metallische moleculen (in dit geval moleculair waterstof) onder extreem hoge druk zich gaan gedragen als een vloeibaar metaal.
Bij extreem lage druk, zoals voorkomt in de ruimte tussen de sterren, komt waterstof vooral voor in de vorm van losse atomen, eenvoudig omdat er geen gelegenheid is om zich tot
een molecuul te combineren.
De gebieden in het heelal zijn veel te koud voor het kunnen ontstaan van moleculen: de temperatuur ligt er rond de -260 graden. Dat betekent dat de atomen niet snel genoeg bewegen om de zogeheten 'reactiebarrière' te overwinnen. Die barrière is een soort weerstand die de atomen moeten overwinnen, voordat ze met elkaar kunnen reageren, net zoals je bij een klemmende deur eerst veel kracht moet zetten voordat hij opengaat.

Hoe kunnen die reacties dan tóch plaatsvinden? ‘Een mogelijkheid, of eigenlijk dé mogelijkheid, is dat het waterstofatoom tunnelt door de barrière'.

Atoommassa helium 4,0026 u
Elektronenconfiguratie: 0 Valentie-elektronen // Orbitaal 1s2
Edelgassen gaan nauwelijks verbinding aan met enig ander element, vandaar geen valentie-elektronen.
Helium is een edelgas, omdat edelgassen per definitie niet of nauwelijks reageren met andere stoffen. Deze zeer geringe reactiviteit wordt veroorzaakt door de stabiele elektronensamenstelling. Uit de (edelgas)elektronenconfiguratie blijkt dat edelgassen nul valentie-elektronen hebben. Er zijn dus geen elektronen beschikbaar om een gemeenschappelijk elektronenpaar te vormen met een ander atoom, en er zal dan ook geen reactie optreden.
Deze configuratie is een energetisch gunstige samenstelling, die in wezen ook nagestreefd wordt door alle atomen in hun verbindingen. Dat is de grond voor de zogenoemde octetregel, die zegt dat atomen op een zodanige manier proberen te combineren dat ze elk acht elektronen in hun buitenste schil, de valentieschil, hebben. Op deze manier krijgen ze dezelfde elektronenconfiguratie als een edelgas, de zogenaamde octetstructuur. Er is een octetstructuur wanneer een element 8 elektronen op de buitenste schil heeft. Dit is chemisch de meest stabiele toestand: elk element streeft rust na, wil stabiel zijn! Nagenoeg alle elementen moeten om deze stabiele toestand, chemische bindingen aangaan. De edelgassen zijn hierop een uitzondering, zij hebben deze toestand reeds bereikt en reageren daarom niet.

Het element Helium (He) is het eerst ontdekt in de Fraunhoferlijnen van de Zon. Ook Waterstof (H), Koolstof(C), Stikstof(N), Zuurstof(O) en IJzer(Fe) zijn in deze lijnen zichtbaar en dus ook aanwezig als elementen.
Per seconde wordt er ruim 600 miljoen ton aan waterstof omgezet in helium. Iedere seconde komt er voldoende vrij om zo’n 7500 Nederlandse huishoudens een jaar lang van elektriciteit te voorzien. De omzetting van één gram materie naar energie levert ongeveer 90 biljoen joule aan energie op.
- 1 biljoen = 1012 = 1.000.000.000.000 oftewel miljoen maal miljoen. 1 kWh is 3.600.000 J of 3,6 MJ = 3,6 miljoen joule
- 90 biljoen : 3,6 miljoen = 25.000.000.000.000 = 25 miljoen x miljoen kWh

Een waterstofkern die bestaat uit één proton en één neutron (“deuterium”), wordt samengevoegd met een waterstofkern die bestaat uit één proton en twee neutronen (“tritium”). Het resultaat is een instabiele kern met twee protonen en drie neutronen. Deze valt uiteen in een heliumatoom en een neutron, en er ontstaat deuterium en tritium.
Alle energiecentrales op de hele wereld produceren samen per jaar 1011 kWh. Dus moeten alle centrales ‘n miljoen jaar draaien om evenveel energie te produceren als de Zon!

Atoommassa 12,011 u
4 Valentie-elektronen // Orbitaal [He]2s2 2p2
t/m Neon wordt de elektronen-configuratie verkort weergegeven door te beginnen met configuratie van Helium (1s2)

Wat is een diamant?
Diamant bestaat uit zuivere koolstof die kristalliseert ten gevolge van zeer hoge druk en temperatuur. Deze omstandigheden worden alleen gevonden in een diepte van 150 tot 200 kilometer onder het aardoppervlak!
Koolstof is een niet-metaal dat in verschillende vormen voorkomt zoals diamant en grafiet.
Diamant en grafiet. beide zijn gelijksoortige vormen van koolstof, zijn al heel lang bekende vormen van koolstof. Grafiet-t.o.v.-diamant. Grafiet bestaat net als diamant uit pure koolstof. De twee mineralen verschillen alleen van elkaar door de samenstelling van de koolstof atomen. In grafiet zijn de atoomlagen met elkaar verbonden, daarom kunnen we ermee schrijven.
Verbindingen met koolstof en waterstof komen het meest voor. De eenvoudigste koolwaterstof is methaan CH4

- Methaan is na kooldioxide het belangrijkste broeikasgas dat bijdraagt aan de versterking van het broeikaseffect.
Variaties in de hoeveelheid in het verleden hangen sterk samen met veranderingen in CO2 en temperatuur. De ijstijden kenden de kleinste hoeveelheden methaan. In warme periodes (interglacialen) nam de hoeveelheid methaan weer toe. - Methaan is als broeikasgas 21 keer krachtiger als CO2. Men schat dat methaan, ondanks de relatief kleine hoeveelheid ervan in de atmosfeer, verantwoordelijk is voor 15 – 17 % van alle opwarming die de afgelopen eeuw op de aarde heeft plaatsgevonden.
- Methaan komt vrij bij de ontginning van aardolie en gas. Verder wordt methaan gevormd bij een onvolledige verbranding (bijv. bij het platbranden van tropisch regenwoud) of door gisting van organisch materiaal zoals op stortplaatsen en in waterrijke gebieden. Bij herkauwers (koeien, schapen, geiten …) gist het voedsel dat ze eten in hun maag en daarbij wordt methaan gevormd. Methaan komt dus ook in grote mate vrij als bijproduct in de steeds intensiever wordende veeteelt.
- De permafrost in het noordpoolgebied is al duizenden jaren bevroren. Met de opwarming van de aarde komt daarin langzaam verandering. Het leefgebied van bepaalde diersoorten verdwijnt, maar er ligt een groter gevaar op de loer: methaangassen.
- KNMI.nl/uitleg/broeikasgas-methaan.

Atoommassa 14,0067 u
5 Valentie-elektronen // Orbitaal [He]2s2 2p3
Stikstof is een niet-metaal en is ’n voorwaarde voor alle leven op aarde. Het vormt namelijk de basis van ons DNA en onze eiwitten. De lucht om ons heen zit van nature vol stikstof. De samenstelling van de atmosfeer bestaat voor 78% uit stikstof en slechts voor 21% uit zuurstof. Wij mensen hebben echter geen gebonden of ongebonden vorm van stikstof nodig om van te leven. Voedingsstikstof stelt planten in staat eiwitten te maken die dienen als voedsel voor dieren en mensen.
Bliksemfixatie stikstof.
Stikstof wordt ook gecreëerd door bliksem in de lucht en door activiteit van microben in de aarde, waar het als bron en tevens een proces dient in de stikstofkringloop.
Bliksem kan nitraat (NO3-) vormen, dat middels neerslag in de bodem terecht kan komen.
De moderne naam stikstof werd voor het eerst gesuggereerd in 1790 door de Franse chemicus Jean Antoine Claude Chaptal (1756-1832). Deze naam was logisch voor chemici toen ze zich realiseerden dat het nieuwe gas aanwezig was in salpeterzuur en nitraten. Nitrogen is de samenvoeging van nitraat en salpeterzuur (nitro) en (gen) = “oorsprong van”. (nitrogen is het Engelse woord voor stikstof)
Enkele belangrijke doorbraken in de luchtstudie vonden plaats in het jaar 1770. De sleutel was een eenvoudig experiment dat wetenschapsstudenten vandaag nog steeds doen. Het experiment begint met een lege fles die ondersteboven in een bak water wordt geplaatst. De lucht in de fles kan niet ontsnappen.
Proefje: Kaarsje onder glas. Simpel proefje, maar … – Slimme Handen
Als de glazen pot over de kaars heen is geplaatst, is de beschikbare zuurstof maar beperkt. De vlam krijgt als het ware geen frisse lucht en stikt dus. De zuurstof in de omgekeerde fles is tijdens de verbranding allemaal omgezet in koolstofdioxide.
Dit eenvoudige experiment laat zien dat lucht bestaat uit twee verschillende elementen: zuurstof en iets anders. Een van de eerste mensen die ontdekte wat het ‘iets anders’ is, is de Schotse arts en chemicus Daniel Rutherford (1749-1819). Hij noemde dat andere: noxious air, schadelijke lucht, omdat een vlam er in dooft. De Nederlandse benaming stikstof wijst op het feit dat het gas dieren doet stikken.
Waarneming bij het proefje: Na verloop van tijd wordt het vlammetje van de kaars minder hoog en dooft uiteindelijk.
Verklaring: Voor de verbranding van kaarsvet (het vlammetje dus) is onder andere zuurstof nodig. Kaarsvet is gemaakt van paraffine, stoffen die bestaan uit koolstof- en waterstofatomen. Dit vaste kaarsvet wordt eerst vloeibaar door de warmte, waarna het verdampt. Dit verdampte kaarsvet is de eigenlijke brandstof voor de verbranding. Tijdens de verbranding wordt zuurstof uit de lucht omgezet in koolstofdioxide (CO2) en het is dus géén stikstof ‘die de vlam deed stikken’ zoals Daniel Rutherford beweerde.
Verbranding is een chemische reactie, wat betekent dat beginstoffen kunnen veranderen in andere eindstoffen. Atomen maken een andere combinatie zodat er andere moleculen ontstaan. De koolstofatomen in het kaarsvet vormen samen met de zuurstofatomen in de lucht, koolstofdioxide. De waterstofatomen in het kaarsvet combineren ook met zuurstofatomen, maar hier ontstaat H2O oftewel water(damp)!
Stikstofdioxide speelt ook een belangrijke rol in de atmosferische chemie, omdat het tot de productie van ozon in de troposfeer leidt. De troposfeer is het deel van de atmosfeer dat zich tot tussen de acht en zestien kilometer boven de grond uitstrekt. Luchtvervuiling door stikstofdioxide
Het stikstofprobleem: Feiten en fabels over Stikstof

Atoommassa 15,999 u
2 Valentie-elektronen // Orbitaal [He]2s22p4
Hoewel zuurstof iets gewoons en vanzelfsprekends is, vind ik het juist heel boeiend voor een verdieping in dit toch wel heel bijzondere element. Drie miljard jaar geleden was er nauwelijks vrije zuurstof, maar die was voornamelijk gebonden aan koolstof door talloze vulkaanuitbarstingen. De atmosfeer bestond uit waterdamp, CO2 en stikstof.
Honderden miljoenen jaren lang was dit de aanblik van de vroege Aarde.
Zo’n drie miljard jaar geleden begonnen cyanobacteriën via fotosynthese de atmosfeer van zuurstof te voorzien.
Cyanobacteriën zijn foto-autotroof wat betekent dat ze rechtstreeks kooldioxide en water kunnen synthetiseren (samenvoegen) met behulp van energie uit het zonlicht. Het zonlicht wordt opgenomen door bladgroenkorrels in de bacteriecellen met behulp van de energie van het zonlicht wordt water en koolstofdioxide omgezet in glucose, met als afvalproduct zuurstof.

Kolonies kalkrijke stromatolieten werden zo’n 2,8 miljard jaar geleden gevormd door cyanobacteriën. Hun kolonies boden bescherming tegen de aanwezigheid van zuren en andere opgeloste anorganische stoffen in de oerwateren van de Aarde.

Fotosynthese is voor ons een zeer ingewikkeld quantumproces.
Video How-quantum-biology-might-explain-lifes-biggest-questions.
Bacteriën passen dit echter al ruim 2,5 miljard jaar toe, zonder er over na te hoeven denken. Ook al bijna 450 miljoen jaar is dit complex ogend mechanisme bekend in de plantenwereld.

Elke seconde straalt de zon duizenden biljoenen lichtdeeltjes uit. Zonlicht landt op het blad in quantumpakketjes: fotonen. Deze lichtdeeltjes zijn elektromagnetische golfjes met een welbepaalde energie. Allereerst komt deze energie aan bij een zogeheten ‘antenne’, ’n verzameling van honderdduizenden chloroplasten (bladgroenkorrels)
Planten hebben een plantaardige celcyclus. In plantencellen bevinden zich bladgroenkorrels of chloroplasten. Bladgroenkorrels kennen ook een membraan, de thylakoid, die is opgebouwd uit eiwitten en vetten. Hierin liggen verzamelingen van enkele honderden chlorofyl-moleculen ingebed, de zogeheten fotosystemen, dit zijn eiwitten en moleculen die samen de energietoelevering verzorgen voor de fotosynthese. Ze functioneren als 'antennes', die lichtdeeltjes van de zon opvangen. Fotosystemen absorberen vooral blauw en rood licht; groen licht wordt juist verstrooid. Daarom zijn planten groen.
Als het fotosysteem een lichtdeeltje (foton) opvangt, wordt de lichtenergie overgenomen door een elektron, dat daardoor in een hogere baan springt, excitatie genoemd. Het elektron, in deze toestand wordt daarom ook exciton genoemd. Het exciton kan door trillingen van molecuul naar molecuul springen en zo door het fotosysteem bewegen.
Het overbruggingsgebied is een ware nachtmerrie, want het exciton (het energiepakketje) moet zo snel mogelijk door het doolhof heen zien te springen om in het reactiecentrum te komen.
Als het namelijk te lang duurt om het reactiecentrum te bereiken heeft het exciton te weinig tijd om op tijd te komen en is al de energie reeds opgenomen. Slechts 1 nanoseconde heeft het aangeslagen electron hier de tijd voor, dit is ’n miljardste seconde. Fotosynthese is een uiterst nauwkeurig, bijna uitgekiend biologisch quantumproces op ultra kleine schaal in 'n extreem kort tijdbestek.
Naast gewone zuurstof, met twee zuurstofatomen per molecuul (O2), bestaat er ook zuurstof met drie zuurstofatomen (O3 ) Ozon.

In principe is ozon niets anders dan zuurstof (O2) waaraan zich door een hoog energetische spanning of een chemische reactie een extra zuurstofatoom heeft gekoppeld waardoor Ozon (O3) ontstaat. Het bekendste voorbeeld is de vorming van de ozonlaag, waar ozon wordt geproduceerd door de energetische ultraviolette stralen van de zon.
Ozon wordt ook aangemaakt bij onweersbuien en watervallen. De speciale frisse geur die men ruikt na een onweersbui is ozon. Het woord ozon is afgeleid van het Griekse woord ozein, dat ruiken betekent.
Ozon op grote hoogte

De Ozonlaag op een hoogte tussen de 15 en 50 kilometer.
.....de ozonlaag tussen ons en de ruimte heeft een dikte van slechts 3 mm!
Ozon in de lagere atmosfeer
In de troposfeer, waar ons weer zich afspeelt tussen 0 en 10 km, zit het meeste gas van onze dampkring: 90%. Hierin ademen we, en lozen we onze afvalgassen. Omdat de luchtlagen boven de troposfeer de meeste zonnestraling absorberen, bereikt maar weinig straling de troposfeer. Bovenin deze luchtlaag is het zeer koud: -60 °C. In de troposfeer zit van nature weinig ozon: er dringt te weinig zonlicht door om ozon uit zuurstof te vormen, zoals dat in de stratosfeer wel gebeurt.
Ultraviolette straling
In de stratosfeer, tussen 10 en 40 km, botst het licht van de zon op moleculen van de aardse atmosfeer. Licht heeft zóveel energie dat elke atoombinding in een molecuul stuk gaat. Dat kost steeds een molecuul, maar zo komt dit energierijke licht niet op aarde.
Ultraviolet A 400 – 315 nm: 98,7% van deze straling bereikt het aardoppervlak
Ultraviolet B 315 – 280 nm: slechts 1,3% bereikt het aardoppervlak
Ultraviolet C 280 – 100 nm: wordt volledig tegengehouden door de ozonlaag
Smog
Met een klein beetje stikstofmonoxide kan een vrij grote hoeveelheid ozon ontstaan. En hier beginnen de problemen. In automotoren wordt een beetje stikstofmonoxide NO gevormd, en ook in energiecentrales. Ook in huis wordt in allerlei apparaten een klein beetje NO gevormd. Zelfs de mens zelf blijkt een beetje NO te vormen. Al dit NO kan in de lucht ozon vormen. Een ozonconcentratie van 400 mg/m3 is te ruiken, en boven 600 mg/m3 veroorzaakt ozon irritatie van ogen, neus, keel en luchtwegen, en verder hoofdpijn, misselijkheid en benauwdheid.
Hetzelfde gas dat op grote hoogte, in de stratosfeer, het leven beschermt, is dichtbij, in de troposfeer, een vervuiler. Alleen de hoogte in de atmosfeer bepaalt of ozon vriend of vijand is.

Atoommassa 55,845 u
6 Valentie-elektronen // Orbitaal [Ar] 3d6 4s2
In het binnenste van een zware ster worden uiteindelijk atoomkernen van ijzer gevormd, en dat zijn de meest stabiele atoomkernen die er zijn.
Je zou kunnen zeggen dat ijzer in een zware ster het element is, dat de aanleiding was tot de vorming van alle atomen en isotopen die we kennen, nadat de ster geëxplodeerd was als Supernova.
Nog twee cruciale elementen: Zwavel voor het leven op Aarde, en Calcium voor het leven in de oceanen.
Zwavel

Atoommassa 32,06 u
6 Valentie-elektronen // Orbitaal [Ne =1s22s2 2p6 ]3s2 3p4
Zwavelbronnen Krysuvik in IJsland.
Voor mij waren het geen verstikkende walmen met typische geuren van 'rotte eieren'.
Toen ik in deze warme vochtige mistflarden liep, overweldigde mij de gedachte, dat ik de hete elementaire uitademing van dit stukje IJsland aan het inademen was.
Bron foto: Hans Daemen
Calcium
De naam is afkomstig van het Latijnse Calx, dat “kalksteen” betekent. Omdat calcium ook in hoge concentraties aanwezig is in het zeewater, is het van essentieel belang voor de groei van steenkoralen. Het skelet van steenkoralen bestaat uit calciumcarbonaat. Koraal, ook wel poliepen genoemd, zijn dieren die in de zee groeien, en maken een skelet van kalk. Koraal is dus niet – zoals veel mensen denken – een plant of steen, het bestaat uit vele kleine diertjes, algen. Via fotosynthese zetten ze koolstofdioxide die van het koraal komt om in zuurstof, die nodig is voor de poliepen om te overleven. Verder maken deze algensoorten ook koolhydraten via fotosynthese, die de koralen voorzien in hun voedselbehoefte. Het koraal vangt zelf ook wel wat voedsel, dit doen de koraalpoliepen met behulp van kleine tentakels die voedsel (minuscule zeediertjes) uit het water kunnen filteren.
Bron video: National Geographic



















