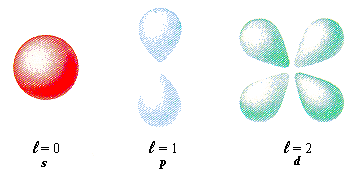Chemici hebben altijd methoden gezocht om elementen te ordenen en hun overeenkomstige eigenschappen te tonen. Historisch gezien gebruikten wetenschappers de massa van atomen om elementen te ordenen, omdat de subatomaire deeltjes protonen, neutronen en elektronen gewoonweg nog niet waren ontdekt…..bijna niet voor te stellen!
- In 1897 werd het elektron ontdekt door J.J. Thomson
- In 1919 werd het proton ontdekt door Ernest Rutherford
- In 1932 ontdekte James Chadwick het neutron
De vraag die natuurkundigen daarna stelden was, of de ontdekte elektronen, protonen, neutronen golven of deeltjes zijn? Die vraag wordt straks beantwoord.
Een andere vraag van de meeste chemici wie het periodieke systeem heeft ontdekt, wordt onmiddelijk beantwoord met: Dmitri Mendelejev. Die was inderdaad de eerste die een herkenbare versie van de tabel publiceerde, maar of hij alle eer verdient, is een vraag.
Een aantal chemici vóór Mendelejev onderzochten al patronen in de eigenschappen van elementen die op dat moment bekend waren. De vroegste poging om de elementen te classificeren was in 1789, toen Antoine Lavoisier de elementen op basis van hun eigenschappen groepeerde in gassen, niet-metalen, metalen en ‘aarden’.
- 'Aarden' duidde op een groep stoffen die men ooit als eenvoudig en onafbreekbaar beschouwde, maar die nu bekend staan als metalen van de aard- en zeebodem, calcium bijvoorbeeld.
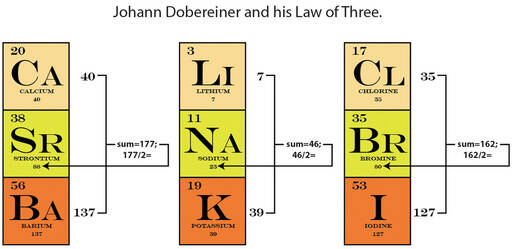
In de navolgende decennia werden verschillende andere pogingen ondernomen om elementen te groeperen. In 1829 herkende Johann Döbereiner triaden van elementen met chemisch vergelijkbare eigenschappen, en toonde aan dat de eigenschappen van het middelste element konden worden voorspeld op basis van de eigenschappen van de andere twee.
Pas toen een nauwkeuriger lijst van de atoommassa van de elementen beschikbaar kwam op een conferentie in Karlsruhe, Duitsland in 1860, werd er echte vooruitgang geboekt in de richting van de ontdekking van het moderne periodiek systeem..
Er bestaat een grote diversiteit aan periodieke systemen, die voortvloeien uit de diverse grafische, wiskundige, fysische en chemische criteria die worden toegepast. Talrijke vooraanstaande wetenschappers, gedreven door hun verlangen om meer te begrijpen over de atomen waaruit alles om ons heen is opgebouwd, hebben uiteindelijk bijgedragen aan de vorming van het periodiek systeem zoals we dat vandaag de dag kennen.
De koppeling hieronder geeft een interactieve mogelijkheid om door het Periodiek Systeem te navigeren. Je kunt dubbelklikken op elk afzonderlijk element voor uitgebreide informatie.
Interactief periodiek systeem
De allereerste pioniers van het systeem.
- Alexandre-Emile Béguyer de Chancourtois was de eerste die een periodiek systeem ontwierp, bekend als de tellurische helix. Dit systeem wordt voorgesteld als een verticaal geplaatste cilinder met elementen gerangschikt in stijgende atoommassa langs een spiraal die om de cilinder heen loopt.
- John Newlands formuleerde de theorie dat elementen in "octaven" gerangschikt konden worden. Na het ordenen van de elementen op basis van toenemend atoomgewicht suggereerde hij dat bepaalde eigenschappen zich bij elk achtste element herhaalden.
- Julius Lothar Meyer merkte op dat wanneer elementen worden geordend op basis van hun atoomgewicht, ze groeperen in sets met vergelijkbare fysieke en chemische eigenschappen, die zich op periodieke intervallen herhalen.
- Hendrik Moseley ontdekte de relatie tussen de röntgenspectra van elementen en hun atoomnummers
De opkomst van quantumfysica heeft geleid tot een vernieuwde methode voor het classificeren van elementen. De ontdekking van het elektron in 1897 en de daaropvolgende ontwikkeling van de steeds belangrijker wordende fysica, maakten het mogelijk om de rangschikking van elektronen rond de atoomkern écht te begrijpen.
Maar om een duidelijk inzicht te verkrijgen in de geschiedenis van de chemie en de evolutie ervan naar de kwantumfysica toe, is het nodig wat periodes terug te gaan in de tijd.
The Four Elements
De mentale betrokkenheid van de mensheid bij de natuur, en hoe dit alles er is dateert zéker van vóór de beschaving. Filosofisch, en ook het niet-religieus denken over de natuurlijke wereld, gaat terug tot het oude Griekenland.
De oude Grieken waren van mening dat alles bestond uit vier elementen: aarde, water, lucht en vuur. Deze theorie, voorgesteld rond 450 voor onze jaartelling, werd later verder ontwikkeld en ondersteund door Aristoteles. Het idee dat de vier genoemde elementen alle materie vormden, was bijna tweeduizend jaar lang de hoeksteen van filosofie, wetenschap en geneeskunde.
Aristoteles classificeerde elementen door ze te beoordelen op hun eigenschappen: warm, koud, nat of droog.
- Vuur en aarde waren droog.
- Lucht en water waren nat.
- Vuur en lucht waren heet.
- Aarde en water waren koud
Transmutatie, het omzetten van het ene chemische element in het andere.
In de oudheid waren natuurfilosofen bezig met het onderzoeken van de aard van de materie en het zoeken naar de oorsprong en de fundamentele bouwstenen van het universum. Ze stelden vragen over de aard van de elementen, de oorsprong van het leven en de structuur van de kosmos.
Natuurfilosofen in de oudheid waren geïnteresseerd in het begrijpen van de aard van de elementen en de mogelijkheid van transmutatie, het veranderen van iets in iets anders. Ze stelden zich vragen over hoe de verschillende elementen met elkaar verbonden waren en hoe ze konden worden getransformeerd. Hoewel ze niet dezelfde experimentele methoden hadden als de latere alchemisten, waren ze zich bewust van het concept van transmutatie.
Natuurfilosofen zoals Empedocles en Heraclitus geloofden dat de vier elementen aarde, water, lucht en vuur konden worden samengevoegd of getransformeerd om verschillende vormen van materie te creëren. Ze zagen verandering en transformatie als inherente eigenschappen van de natuur.
Na verloop van tijd begonnen sommige natuurfilosofen zich te interesseren voor praktische toepassingen van hun kennis, zoals het verkrijgen van medicijnen of materialen met speciale eigenschappen. Dit leidde tot de opkomst van de alchemie als een praktische tak van de natuurfilosofie. Alchemie combineerde elementen van de natuurfilosofie, chemie, mystiek en spiritualiteit.
De ontwikkeling van natuurfilosofie tot alchemie was een geleidelijk proces dat plaatsvond over een lange periode en werd beïnvloed door verschillende culturen en tradities.
Alchemie werd door de eeuwen heen beïnvloed door verschillende culturen, zoals de Arabische, Chinese en Europese alchemie. In de Arabische wereld werden de alchemistische tradities uit de oudheid bewaard en verder ontwikkeld. In China waren alchemisten op zoek naar onsterfelijkheid en de transformatie van het lichaam. In Europa vond de alchemie haar hoogtepunt tijdens de middeleeuwen en de renaissance, waarbij alchemisten zoals Paracelsus en Isaac Newton prominent waren.
Het woord alchemie is afgeleid van de Arabische uitdrukking "al-kimia", die verwijst naar de bereiding van de steen of het elixer door de Egyptenaren.
De Arabische wortel "kimia" komt van het Koptische "khem" dat zinspeelde op de vruchtbare zwarte grond van de Nijldelta.
Esoterisch en hiëroglief verwijst het woord naar het duistere mysterie van de oorspronkelijke of Prima Materia (de Khem).
De kunst van de alchemie werd door de eeuwen heen doorgegeven van Egypte en Arabië naar Griekenland en Rome, en uiteindelijk naar West- en Midden-Europa. Er zijn dus verschillende bronnen, die elkaar aanvullen
In de Middeleeuwen begon men in te zien dat het Griekse systeem van klassieke elementen niet universeel was, dus verzonnen de alchemisten er drie bij om het Aristotelische systeem aan te vullen.
-
Mercury (kwikzilver)
-
Sulfer (zwavel)
-
Salt
Zwavel staat in de alchemie voor het spirituele, de ziel. Kwikzilver staat voor de geest. Zout staat voor materie.
Die stoffen werden sinds de oudheid geïdentificeerd als reactiemiddelen die in staat zijn om stoffen aanzienlijk in iets anders te veranderen. Ze waren zowel schaars als bijzonder, kwamen uit exotische plaatsen zoals vulkanen of zeldzame mijnen, en losten metalen op of creëerden zwavelzouten die de eigenschappen van gewone elementen aanzienlijk veranderden. Dit maakte ze mysterieus en veel mensen wijdden hun leven aan het proberen te begrijpen hoe ze werkten en wat je ermee kon doen. Kwikzilver, zwavel en zout vertoonden nieuwe eigenschappen, wat de alchemisten enthousiasmeerde. Ze waren ervan overtuigd dat ze nu nieuwe substanties konden maken, of beter nog, met gemak waardevolle materialen zoals zilver en goud konden vervaardigen!!!
Alchemie interesseerde denkers en beoefenaars uit vele oude culturen omdat het vragen stelde die relevant waren voor de natuurfilosofie, zoals: Hoe ontstaan dingen? Waar zijn dingen van gemaakt? Kunnen sommige dingen worden omgezet in andere dingen? Het essentiële idee van alchemie is dat het antwoord op de derde vraag ja is. De kunst is dus om het antwoord op de eerste twee vragen te vinden en zo de recepten en apparaten te ontdekken die nodig zijn om veelgevraagde kostbare stoffen zoals goud te creëren, altijd bewonderd om zijn onvergankelijkheid. Alchemisten geloofden dat ze onzuiverheden uit een stof konden verwijderen en zo een geheel andere stof konden maken. Omgekeerd zouden ze stoffen kunnen mengen en een nieuwe stof kunnen creëren met heel andere eigenschappen.
De echte zoektocht voor alchemisten was, om ‘de Steen der Wijzen’ te vinden, dat waarschijnlijk geen fysieke steen was, maar eerder een substantie of tinctuur, bekend als 'materia prima', iets elementairs.
Alchemisten waren geïnteresseerd in het transmuteren, het omzetten van materie, waarbij ze streefden naar het vinden van de "steen der wijzen" / "the philosophers stone", die werd verondersteld in staat te zijn om basismetalen om te zetten in edele metalen zoals goud en zilver.
De term "Philosophers Stone" is afgeleid van de alchemistische zoektocht naar het begrijpen en beheersen van de essentie van materie, ook wel de "prima materia" genoemd. De alchemistische zoektocht naar de steen der wijzen kan worden gezien als een voortzetting van de bredere filosofische vragen over de aard van de materie en de transformatie ervan die werden gesteld door de oude filosofen, waaronder Plato en Aristoteles. Filosofen streven naar een dieper begrip van de aard der dingen en proberen de mysteries van het bestaan te doorgronden.
De alchemistische zoektocht naar de Steen der Wijzen is niet alleen een letterlijk streven naar het transmuteren, naar het veranderen van metalen, maar ook een symbolische zoektocht naar spirituele transformatie en het bereiken van verlichting. De alchemisten geloofden dat de transmutatie van materie parallel liep aan de transformatie van de menselijke ziel.
Newton, één van de meest bekende wetenschappers in de geschiedenis, was ook sterk geïnteresseerd in alchemie en had een dieper spiritueel streven naast zijn wetenschappelijk werk. Hij was ervan overtuigd dat er een diepere spirituele betekenis lag in de alchemistische transmutatie van materie en dat het begrijpen van de fundamentele principes van de natuur ook inzicht kon bieden in de spirituele werkelijkheid.
Newton bestudeerde uitgebreid alchemistische literatuur en voerde zelf alchemistische experimenten uit. Hij was gefascineerd door de zoektocht naar de steen der wijzen en geloofde dat het begrijpen van de transformatie van materie ook de sleutel kon zijn tot het begrijpen van de mysteries van het universum. Hij leverde pionierswerk in de wiskunde, natuurkunde en astronomie. Zijn belangstelling voor alchemie kan worden beschouwd als onderdeel van zijn uitgebreide intellectuele nieuwsgierigheid en zijn streven naar kennis en begrip.
Alchemisten waren de eersten die zich realiseerden dat elementaire verbindingen konden worden afgebroken tot hun samenstellende delen en vervolgens opnieuw konden worden gecombineerd. Dat is iets wat Newton uit de alchemie haalde. Hij paste dat vervolgens toe op wit licht, dat hij deconstrueerde in samenstellende kleuren. Vervolgens plaatste hij ook een tweede prisma van hetzelfde type in het pad van het licht en was in staat om de kleuren weer om te zetten in wit licht. Ook ontdekte hij dat gekleurd licht óók nog ‘ns opgesplitst kan worden in meerdere kleuren.
Alchemisten waren de eersten die begrepen dat samengestelde stoffen konden worden teruggebracht tot hun basiselementen. Deze basiselementen werden enkele eeuwen later bijeengebracht in een poging om een periodiek systeem van elementen te creëren.
Antoine Lavoisier classificeerde in 1789 de elementen op basis van hun eigenschappen. Hij groepeerde in gassen, metalen en niet-metalen.
In 1829 herkende Johann Döbereiner triaden van 3 elementen met chemisch vergelijkbare eigenschappen. Hij probeerde aan te tonen dat in elke triade het gemiddelde van de lichtste en zwaarste atoomgewichten het atoomgewicht van het middelste element benaderde. Maar hij kon slechts enkele triaden onderscheiden, en bleek niet in staat om ‘drieklanken’ te maken van alle bekende elementen…………Pas toen in 1860 een nauwkeuriger lijst van de atoommassa van de elementen beschikbaar kwam, werd er enige vooruitgang geboekt in de richting van de ontdekking van het moderne periodiek systeem.
In de periode tussen 1862 en 1868 ontwikkelen meerdere wetenschappers onafhankelijk van elkaar belangrijke voorlopers van het periodiek systeem. De eerste is de Franse geoloog Alexandre-Emile Béguyer De Chancourtois, die de elementen in een lijn rangschikt in volgorde van toenemend atoomgewicht. Deze lijn wordt vervolgens spiraalvormig rond een metalen cilinder geplaatst, zodat soortgelijke elementen langs verticale lijnen vallen die over de lengte van de cilinder zijn getrokken.
Julius Lothar Meyer, een Duitse chemicus, publiceert in 1868 een aantal periodieke systemen die de ontdekking van een volledig volwassen tafelsysteem vertegenwoordigen. Hoewel hij met succes de meeste van de meer dan 60 toen bekende elementen onderbrengt, slaagt Lothar Meyer er niet in om nieuwe of ontbrekende elementen te voorspellen, op één uitzondering na. Hij deed een voorlopige voorspelling voor het bestaan van een enkel element waarvan hij dacht dat het een atoomgewicht van 44,55 zou hebben. Dit element zou uiteindelijk in Zweden worden ontdekt en scandium worden genoemd. Het gewicht was 44,6 toen het voor het eerst werd gemeten.
Dmitri Mendelejev
Dmitri Mendelejev was in 1869 de eerste die een versie van het periodiek systeem publiceerde die we vandaag de dag kennen.
Volgens de overlevering had Mendelejev een visioen van een complete tabel waarin alle 65 toen bekende elementen waren geordend. De volgende ochtend zou hij onmiddellijk de tabel hebben opgeschreven.
Foto staat in een publiekelijk domein AZ Quotes
Het periodiek systeem van Mendelejev is een systematische ordening van alle elementen die op Aarde voorkomen. Hij rangschikte de elementen ‘simpelweg’ op een oplopende atoommassa.
"Het lijkt mij dat de toepasbaarheid reeds duidelijk wordt weergegeven. Dit is het begin dat ik heb vastgesteld voor de reeks elementen die met zekerheid bekend zijn. Mijn voornaamste doel was, het vinden van een algemeen systeem van elementen. Dit is wat ik heb gevonden"
Zijn eerste publicatie van het periodiek systeem stond in 'één of ander' Russisch tijdschrift.............
De opkomst van quantumfysica
De opkomst van quantumfysica heeft geleid tot een vernieuwde methode voor het classificeren van elementen. De ontdekking van het elektron in 1897 en de daaropvolgende ontwikkeling van de quantumfysica maakten het mogelijk om te begrijpen hoe elektronen rond de atoomkern zijn gerangschikt.
Op atomair niveau functioneert het hele universum volgens de principes van de quantumfysica. Het begrijpen van de fundamentele informatie over de structuur van elk atoom is essentieel voor een goed inzicht in de wezenlijke realiteit van alles in en om ons heen. Dit begrip legt de grondslag voor verdere kennis over alle atomaire en moleculaire verbindingen.
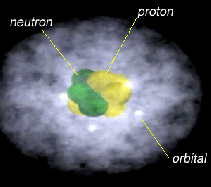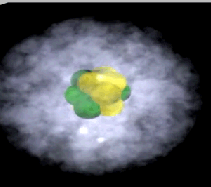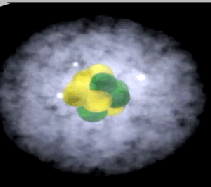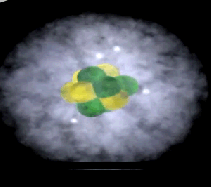
Elektronenwolk
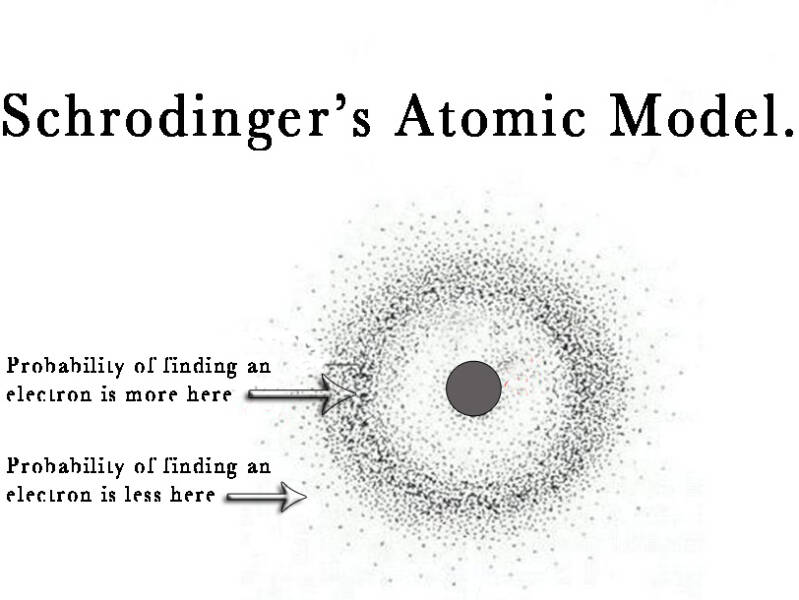
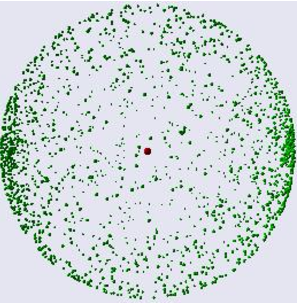
Een atoom heeft geen duidelijk gedefinieerde grens vanwege de elektronenwolk. Deze wolk duidt op het gebied waar een elektron het meest waarschijnlijk aanwezig is (belangrijk: het exacte pad van een elektron is niet vast te stellen, alleen de waarschijnlijkheid van zijn locatie in het gebied). De elektronenwolk, bestaande uit elektronen die om de atoomkern draaien, heeft de hoogste dichtheid direct naast de kern en wordt diffuser naarmate je verder van de kern komt.
Elektronenconfiguratie
Voor de juiste bepaling van de elektronenconfiguratie in een atoom is het noodzakelijk om de volgorde van energieniveaus te kennen. Dit betekent dat de volgorde van individuele subschillen en schillen bepalend is; hoe verder een elektron zich van de kern bevindt, des te meer energie het heeft, des te hoger het energieniveau. De configuratie is simpelweg de toewijzing van individuele elektronen aan verschillende energieniveaus.

In het atoommodel van Bohr uit 1913 bevinden de elektronen van een atoom zich in verschillende schillen rond de kern, elk met een eigen energieniveau. Elke schil heeft een maximumcapaciteit voor het aantal elektronen dat het kan bevatten. In een stabiel atoom bevinden de elektronen zich in de schillen met de laagste energie.
Bij het verdelen van elektronen over de schillen dient men rekening te houden met het volgende:
- Een quantummechanisch principe, stelt dat twee identieke elektronen niet dezelfde spin of identieke quantumgetallen kunnen hebben. Wolfgang Pauli heeft dit uitsluitingsprincipe beschreven.
- De elektronen zitten liefst zo dicht mogelijk tegen de kern (laagste energie-inhoud voor het atoom). De schillen worden dus opgevuld van binnen naar buiten.
Erwin Schrödinger, een Oostenrijkse natuurkundige die essentiële bijdragen heeft geleverd aan de quantumfysica, beschreef de beweging van elektronen met de golfvergelijking. Deze wiskundige formulering bepaalt of de quantumtoestand van een elektron verandert in de loop van de tijd. De quantumtoestand verwijst naar de conditie van een elektron dat zich, afhankelijk van de situatie, als een deeltje of als een golf zal gedragen.
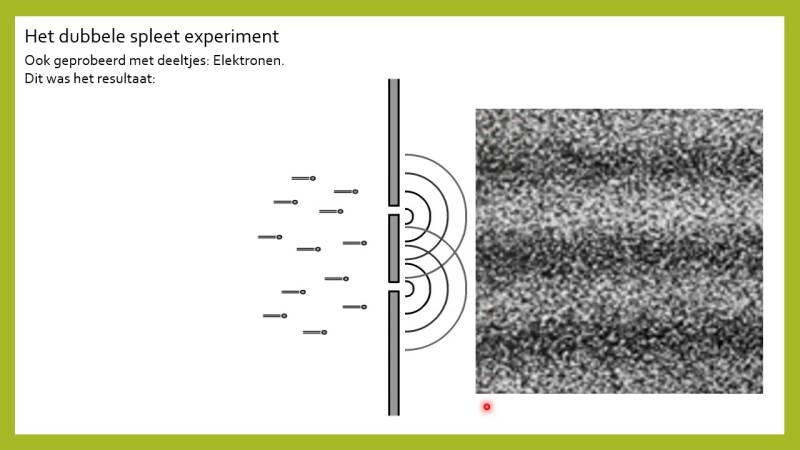
Het 'double slit experiment ' demonstreert de golfachtige eigenschappen van deeltjes op quantumniveau en de interferentie die optreedt in de waarschijnlijkheidsverdeling bij het detecteren van deeltjes op een scherm. Het is een van de cruciale experimenten die de fundamenten van de quantumfysica belichten.
Het double slit experiment kan bij de Schrödingervergelijking worden gebruikt om het verloop van de golffunctie van een deeltje (foton of een elektron) te beschrijven terwijl het door beide spleten beweegt en vervolgens op een scherm in een wel bepaald patroon wordt gedetecteerd. Door de Schrödingervergelijking op te lossen kunnen de interferentiepatronen van de golffunctie voorspeld worden, die op het scherm worden waargenomen.
Max Born, een Duits-Britse wiskundige en natuurkundige, formuleerde het concept van de golf-deeltje dualiteit door te stellen dat alle bouwstenen van de natuur, zoals elektronen of fotonen, zowel deeltjes- als golfachtige eigenschappen vertonen. Hij introduceerde het idee dat de golffunctie, die de evolutie van een quantumdeeltje beschrijft, kan worden geïnterpreteerd als een kans om een deeltje bij een waarneming of meting op een bepaalde plaats aan te treffen.
Louis de Broglie (uitspraak: "De Bròje") een Franse fysicus, stelde voor dat materiedeeltjes, zoals elektronen, kunnen worden beschouwd als deeltjes met een golfachtig karakter. Hij introduceerde het concept van de deeltjesgolf, die wordt gekenmerkt door een golflengte.
De golffunctie beschrijft de atomaire orbitaal, die wiskundig het gebied rond de atoomkern aangeeft waar een elektron waarschijnlijk zal zijn. Op plekken waar de golffunctie het meest intens is, is de kans om het elektron te vinden het grootst. Deze functie vertegenwoordigt een staande golf die overeenkomt met een bepaald energieniveau. In het algemeen geldt dat een hogere orde van de staande golf samenhangt met een hogere energie van de golffunctie.
Het kwadraat van de golffunctie.
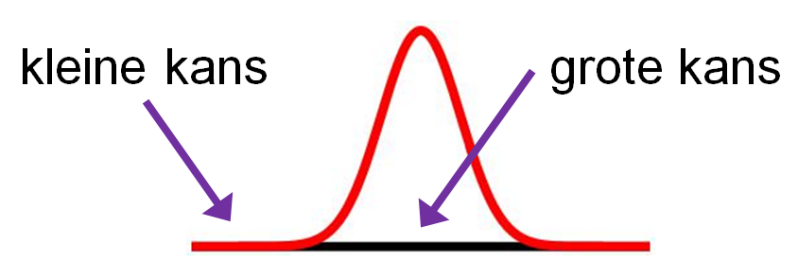
De waarde van een golffunctie is niet altijd positief, wat inhoudt dat het kwadraat ervan als een kansverdeling kan worden opgevat.
Het kwadrateren van functies en variabelen speelt een belangrijke rol in de quantumfysica, met name bij het interpreteren van de golffuncties en het berekenen van waarschijnlijkheden. Door de golf in vorm als het ware "te overdrijven" = hoger en breder te maken, wordt de waarschijnlijkheidsdichtheid groter. Dit komt omdat de waarschijnlijkheidsdichtheid evenredig is met het kwadraat van de amplitude van de golffunctie. Schrijfwijze: Ψ2
Waarschijnlijkheidsinterpretatie:
In de quantumfysica wordt de golffunctie, geïnterpreteerd als een waarschijnlijkheidsamplitude, gebruikt om de kans aan te geven dat je een systeem in een bepaalde quantumtoestand aantreft. Het wordt geschreven als |ψ|2
Het kwadraat van de golffunctie geeft de waarschijnlijkheidsdichtheid weer van het vinden van een deeltje op een bepaalde positie in de ruimte. Het kwadrateren van de golffunctie maakt het mogelijk om probabilistische interpretaties te verkrijgen over de positie van deeltjes.
Het kwadraat van de golffunctie geeft een waarschijnlijkheidsdichtheid aan om een elektron op een bepaalde plek aan te treffen .
De golffunctie ψ is dus een complexe wiskundige grootheid en geen fysieke entiteit. Door de golf in vorm als het ware "te overdrijven" = hoger en breder te maken, wordt de waarschijnlijkheidsdichtheid (kansdichtheid) groter. Dit komt omdat de waarschijnlijkheidsdichtheid evenredig is met het kwadraat van de amplitude van de golffunctie. Hoe hoger en breder de golf = hoe groter het kwadraat, des te groter de waarschijnlijkheidsdichtheid op die plek. De vorm van de golffunctie is direct gekoppeld aan het waarschijnlijke gedrag van deeltjes in de ruimte. Dit resulteert in een grotere ruimtelijke spreiding en verhoogt daarmee de kans om een elektron te detecteren.
In de meest eenvoudige formulering ziet de vergelijking van Schrödinger er als volgt uit:
i is de imaginaire eenheid Complexe getallen zijn de enige getallen waarvan het kwadraat gelijk is aan -1
ħ de constante van Dirac, ook wel genoemd de gereduceerde constante van Planck
∂Ψ/∂t zijn afgeleiden van golffunctie Ψ (spreek uit psi) en tijd t van het elektron. De afgeleiden geven aan hoe de golffunctie (en dus de toestand van het elektron) verandert naarmate de tijd verstrijkt. Het geeft de tijdevolutie van de golffunctie.
Ĥ De Hamiltoniaan beschrijft de totale energie van een systeem, dat wil zeggen, het omvat zowel de kinetische als de potentiële energie.
De linkerkant van de formule beschrijft: "...de verandering van de golffunctie Ψ over tijd..." – en dat is precies de informatie die ons interesseert. De rechterkant van de vergelijking geeft ons dan de methode om die verandering te berekenen.
Oftewel: hoe de golffunctie in de toekomst gaat veranderen, hangt af van wat die golffunctie op dit moment is. D.w.z. waar het elektron in het volgende moment zou kúnnen zijn, hangt af van waar het elektron op dit moment te vinden kán zijn..........
De Schrödinger-vergelijking voorspelt waar het elektron waarschijnlijk zal worden gevonden als je een meting verricht, maar beschrijft niet hoe het zich daadwerkelijk beweegt tussen twee metingen.
De exacte wiskundige oplosbaarheid (analytische oplossing) van de Schrödingervergelijking is alleen mogelijk voor het waterstofatoom (één proton, één elektron). Zodra er meer dan één elektron bij betrokken is (vanaf het heliumatoom), wordt de vergelijking veel complexer door de onderlinge interacties tussen de elektronen. Deze systemen kunnen niet meer exact analytisch worden opgelost en vereisen benaderingssimulaties.
Door de Schrödinger-vergelijking op te lossen, kunnen de mogelijke quantumtoestanden, oftewel de orbitalen van een systeem, bepaald worden. (orbitalen zijn wiskundig omschreven gebieden om de atoomkern, waar elektronen te vinden zouden kunnen zijn, later meer hierover).
Deze orbitalen beschrijven de kansdichtheid om een deeltje op een bepaalde positie te vinden. Elke orbitaal heeft een specifieke energie en een bijbehorende golffunctie. De oplossing van de Schrödinger-vergelijking geeft ons inzicht in hoe de golffunctie in de tijd evolueert en hoe de kansdichtheid van het deeltje verandert.
Functies
- Een functie drukt een afhankelijkheid uit van een getal of element met een ander getal of element.
- Het wiskundige begrip 'functie' heeft in het Nederlandse taalgebied de betekenis, dat het in relatie is met een ander getal of begrip.
- Een functie is een voorschrift dat aan een getal een ander getal of een kwadraat toevoegt.
Er zijn echter nog meer mogelijke voorschriften, we hoeven ons niet tot getallen te beperken:
- het voorschrift dat aan elke auto zijn kenteken toevoegt, is ook en functie
- het voorschrift dat aan elke persoon zijn geboortedatum toevoegt, of de kleur van zijn ogen zijn ook functies.
Een elektron in een atoom heeft een golffunctie die de waarschijnlijkheid beschrijft om het op verschillende locaties in zijn orbitale schil te vinden. Deze golffunctie vertegenwoordigt een superpositie van mogelijke posities en/of energieniveaus. Wanneer een meting wordt gedaan om de locatie van het elektron te bepalen, verandert de golffunctie onmiddellijk in een nieuwe toestand die alleen de gemeten locatie beschrijft. Het elektron bevindt zich nu in een specifieke, meetbare toestand, en de superpositie is verdwenen
De Schrödinger-vergelijking is een complexe differentiaalvergelijking die niet eenvoudig is op te lossen.
Erwin Schrödinger zocht naar een wiskundige vergelijking die de golfachtige aard van deeltjes kon beschrijven, terwijl hij tegelijkertijd verband hield met de klassieke mechanica. Zijn vergelijking is een differentiaalvergelijking die de basisformule vormt voor het beschrijven van een quantummechanisch systeem.
Het oplossen van de vergelijking vereist geavanceerde wiskundige technieken en numerieke benaderingen. Dit omvat bijvoorbeeld het gebruik van softwaresimulaties. Bovendien kan het eigenlijk niet op analytische wijze worden opgelost voor systemen die complexer zijn dan het waterstofatoom.
Het begrip van de Schrödinger-vergelijking en de bijbehorende concepten wordt meestal opgedaan tijdens een universitaire opleiding in de natuurkunde of een verwant vakgebied. Quantumfysica, wiskundige methoden en theoretische fysica zijn nodig om een basis te ontwikkelen voor het begrijpen en oplossen van de Schrödinger-vergelijking.
Het is belangrijk te onthouden dat de Schrödinger-vergelijking is ontwikkeld om het golfgedrag van elektronen te beschrijven.
Elektronen gedragen zich als golven
Het is als ware het voorgeschrevene, en Erwin Schrödinger herschreef het: elektrongolven strekken zich uit met een bepaalde energie in orbitalen. Het voorgeschrevene is de functie. De golffunctie is daarom het golfvoorschrift, dat aangeeft hoe elektrongolven zich uitstrekken in orbitalen met verschillende energieniveaus.
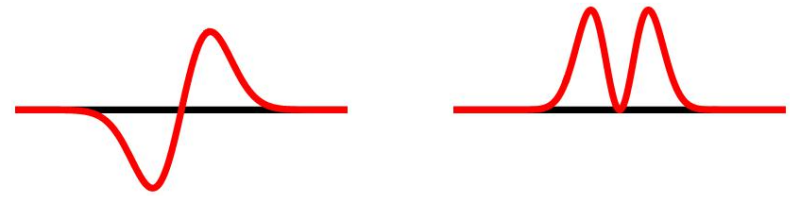
De golffunctie Ψ is een staande golf. Elk van die staande golven correspondeert met een energieniveau: over het algemeen geldt dat hoe hoger de orde van de staande golf, hoe hoger de energie die hoort bij die golffunctie.
Een staande golf is een type golf waarbij bepaalde punten, de zogenaamde knopen waar geen trilling plaatsvindt, op een vaste positie blijven. Evenzo blijven de punten met de maximale trilling, de buiken, ook op een vaste plaats.
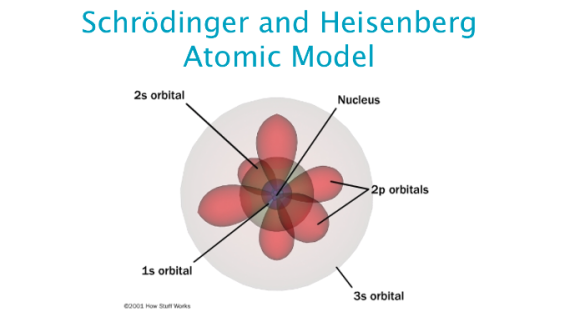
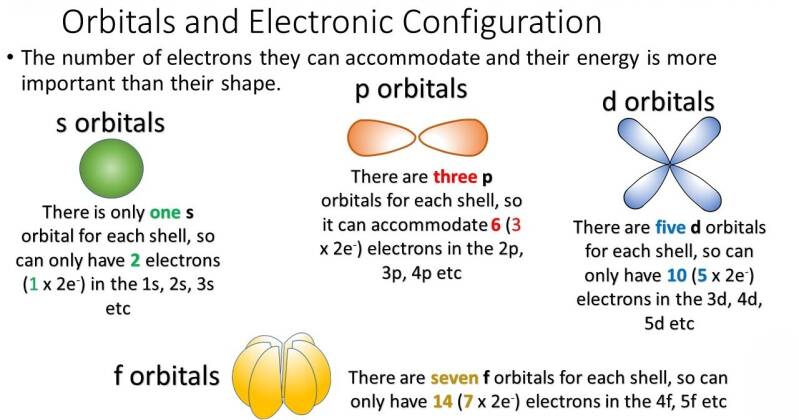
De staande golven in het Schrödinger-model worden vaak weergegeven als driedimensionale "orbitaal"-vormen, die corresponderen met de waarschijnlijkheid van het vinden van een elektron op een bepaalde positie rond de atoomkern. Deze orbitaalvormen kunnen verschillende vormen hebben, zoals s-, p-, d- en f-orbitalen, die elk geassocieerd worden met specifieke energieniveaus van het elektron.
S-, p-, d- en f-orbitalen zijn gebieden binnen een atoom waar elektronen zich waarschijnlijk bevinden, elk met een specifieke vorm en een maximum aantal elektronen dat ze kunnen bevatten. De letters zijn afkomstig van een oud systeem voor het categoriseren van spectraallijnen (scherp, principieel, diffuus en fundamenteel).
Fraunhoferlijnen zijn spectraallijnen. Elke lijn correspondeert met een specifiek chemisch element dat aanwezig is in de atmosfeer van de Zon
In het latere hoofdstukje 'Regels voor het samenstellen van elektronenconfiguraties' meer over s-, p-, d- en f-orbitalen. Het zijn gebieden waar elektronen zich kunnen bevinden.
Hieronder 3D weergaven van orbitalen met verschillende energieniveaus.
Orbitalen zijn overlappende elektronenwolken die worden beschouwd als een waarschijnlijkheidsvelden: ruimtelijke gebieden waar elektronen waarschijnlijk aanwezig zijn. Deze overlappingen vormen de basis van chemische bindingen, waarbij twee atomen meerdere elektronen delen.
De Schrödinger-golffunctie, of golfvergelijking, is cruciaal voor het begrijpen van zowel de elektronenconfiguratie als de nucleaire transformatie van elementen. Transmutatie verwijst specifiek naar het proces waarbij het ene chemische element in een ander wordt omgezet door veranderingen in de kern, zoals bij nucleaire reacties of radioactief verval..
De term 'transmutatie' was oorspronkelijk gerelateerd aan alchemie. Het werd duidelijk dat transmutatie door middel van smelten, verhitten, verbranden, destilleren, enzovoort, niet haalbaar was. Echter, met de ontdekking van radioactiviteit bleek dat transmutatie in bepaalde gevallen wel mogelijk is, namelijk door kernreacties. Nucleaire transmutatie treedt op in elk proces waarbij het aantal protonen of neutronen in de kern van een atoom verandert.
Wat is de afmeting van een atoom en de elektronenwolk eromheen eigenlijk?
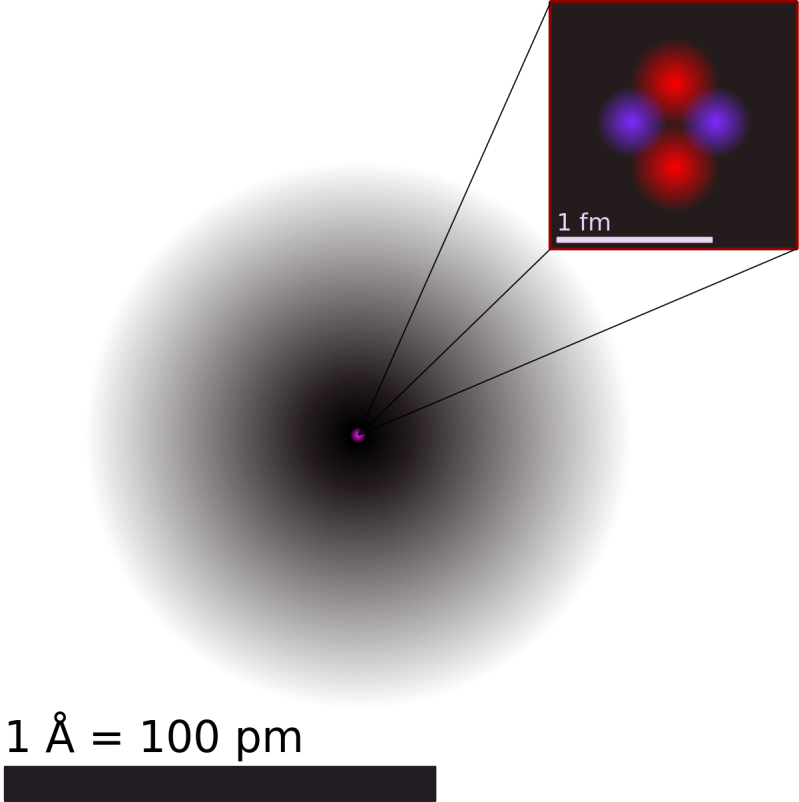
Een atoom is ongeveer een miljoen keer kleiner dan het dikste mensenhaar. De diameter van het atoom varieert van ongeveer 0,2 tot 0,8 nanometer (1 nm 0,000001 mm = 1 miljoenste mm).
Een heliumatoom heeft een diameter van ongeveer 100 picometer, wat neerkomt op 'n tienmiljoenste millimeter. De kern van een atoom is uitzonderlijk klein, met een diameter variërend van 1,6 tot 15 femtometer, wat ongeveer 10.000 keer kleiner is dan het gehele atoom. 1fm = 10-12 mm = 'n biljoenste mm
Het volgende is vrij complex en moeilijk voor te stellen omdat het contra-intuïtief is. Niels Bohr zei ook: "Iedereen die niet geschokt is door de kwantumtheorie, heeft het niet begrepen." Dus als je je verward voelt bij het lezen over kwantumfysica, weet dan dat de wetenschappers die het oorspronkelijk ontwikkelden net zo verward waren................
Bron: CERN

Een orbitaal is een wiskundige beschrijving van de driedimensionale zone waar een elektron, of bij grotere atomen, meerdere elektronen, hoogstwaarschijnlijk rond een atoomkern aangetroffen worden.
Let wel: het betreft beschrijvingen van structuren op nanoschaal, dat wil zeggen, op een schaal van een miljoenste van een millimeter.........
In de quantumfysica beschrijft een orbitaal een wiskundige functie, een wiskundige relatie die zowel de locatie als het golfachtige gedrag van een elektron in een atoom aangeeft. Orbitalen zijn wiskundig gedefinieerde driedimensionale gebieden rond een atoomkern, waarbinnen het zeer waarschijnlijk is om elektronen met specifieke energieniveaus aan te treffen. Je zou orbitalen kunnen duiden als: 'Hier ergens, in deze driedimensionale gebieden, bewegen zich elektronen'
Orbitalen zijn dus geen fysieke objecten: het zijn theoretische constructies die helpen bij het begrijpen, visualiseren en verklaren van de wiskundige oplossingen voor de Schrödingervergelijkingen.
Op elk willekeurig moment kan een elektron op elke afstand van de kern en in elke richting worden gevonden volgens het onzekerheidsprincipe van Heisenberg.
Zoals de animatie 'Wave functions' laat zien, heeft een elektron in een atoom heeft een golffunctie die de waarschijnlijkheid beschrijft om het op verschillende locaties in zijn orbitale schil te vinden. Deze golffunctie vertegenwoordigt een superpositie van mogelijke posities en/of energieniveaus. Wanneer een meting wordt gedaan om de locatie van het elektron te bepalen, verandert de golffunctie onmiddellijk in een nieuwe toestand die alleen de gemeten locatie beschrijft. Het elektron bevindt zich nu in een specifieke, meetbare toestand, en de superpositie is verdwenen.
In wezen zijn golffuncties algemene wiskundige functies die de quantumtoestand van een systeem beschrijven, terwijl orbitalen specifieke oplossingen zijn van de Schrödingervergelijking die de verdeling van elektronen in atomen beschrijven. De golffunctie beschrijft dus wiskundig de atomaire orbitalen, die op hun beurt wiskundig de vormen rond de atoomkern aangeven waar een elektron waarschijnlijk zal zijn. Het zijn dus allebei wiskundige beschrijvingen, zowel de golffuncties als de orbitalen.
De video toont enkele subatomaire deeltjes die onderdeel zijn van een atoom. De begeleidende tekst beschrijft dat een atoom een kern bevat met protonen en neutronen, en dat het omringd wordt door elektronen in zich ontwikkelende orbitalen. Naarmate het atoom groter wordt, neemt het aantal elektronen toe, die verspreidt worden in de verschillende orbitale vormen.
Orbitalen kunnen worden voorgesteld als vaste golfpatronen die ontstaan doordat een elektronengolf gevangen wordt door het elektrische veld van de atoomkern. Ze kunnen eveneens worden voorgesteld als golvende patronen van punten rond de atoomkern. Maar zoals aangegeven, zijn orbitalen wiskundig bepaalde vormen rondom de atoomkern waar het waarschijnlijk is een elektron aan te treffen.
Zoals al eerder is vermeld vertegenwoordigen de letters s, p, d en f de termen scherp, principaal, diffuus en fundamenteel. Deze benamingen zijn ontleend aan de visuele eigenschappen van de fijne structuur in spectraallijnen van atomen.
De naamgeving van de orbitalen hangt samen met de emissiestralen van atomen. Het was het eerste zichtbare teken van kwantificering d.w.z. als vaststelling van een meetbare grootheid. De verschijning van de straal bepaalde de naam van de orbitaal. Een overgang van een p-orbitaal naar een s-orbitaal resulteerde in een scherpe lijn. Een overgang vanuit een d-orbitaal, waar het elektron zich op meerdere energieniveaus kan bevinden, resulteerde in een diffuse lijn.
De s, p, d en f orbitalen worden gekenmerkt door hun vorm en ruimtelijke verdeling. Ze vertegenwoordigen de waarschijnlijkheidsdichtheid voor het vinden van een elektron in een atoom rond de kern. Ondanks dat men zich snel realiseerde dat deze benamingen niet nauwkeurig waren, zijn ze vanwege hun ingeburgerdheid behouden gebleven.
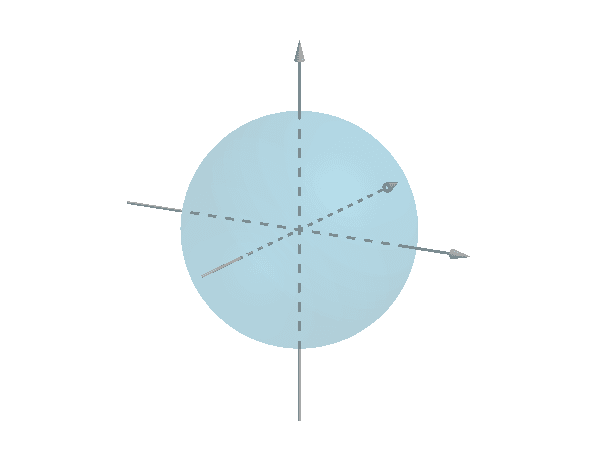
Het s-orbitaal is bolsymmetrisch en er zijn draaiassen in alle richtingen. Het is begrensd binnen een bepaalde afstand van de atoomkern en neemt toe in grootte naarmate de energieniveaus hoger worden. De s-orbitalen kunnen maximaal twee elektronen bevatten, mits het ene elektron spin up heeft en het andere spin down. Ze worden op alle energieniveaus aangetroffen en zijn de orbitalen met de laagste energie.
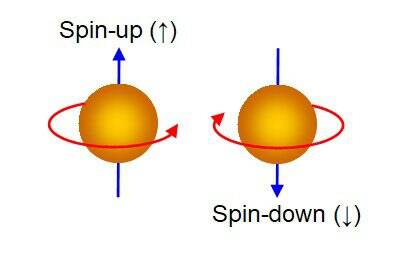
Zowel elektronen als quarks (de fundamentele deeltjes die protonen en neutronen vormen) hebben eigenschappen die we spin noemen, en kunnen maar op twee manieren “rondtollen”: Spin up en Spin down.
'Electronspin' duidt in de context van deeltjesfysica op rotatie, maar het verwijst niet naar een fysieke draaiing van een deeltje rond zijn as. Een punt in de ruimte kan onbeperkt roteren zonder in de knoop te raken. Het is interessant dat na een rotatie van 360°, waarbij de spiraal zowel mét als tegen de klok in draait, het pas na een volledige rotatie van 720° terugkeert naar de oorspronkelijke positie. Overigens, quarks hebben ook spin-rotatie.
Zie ook Spinor voor een scherpe visualisering om spinning voor te kunnen stellen.
Spin is een quantummechanische eigenschap, die op geen enkele wijze met de klassieke mechanica is te beschrijven. Voor deeltjes, en dus ook voor golfjes (!!) is de richting van de spin een belangrijke beschrijving van het impulsmoment.
Elektronen vertonen zowel deeltjes- als golfachtige eigenschappen. Laten we eens kijken naar de relatie tussen spin, golffuncties en impulsmoment:
-
Golffuncties: De paden van elektronen in een atoom worden weergegeven door wiskundige formules, bekend als golffuncties, die overeenkomen met orbitalen.
- s-functies komen overeen met s-orbitalen zijn bolvormig zonder horizontale of verticale knoopvlakken.
- p-functies / p-orbitalen hebben één horizontaal of verticaal knoopvlak.
- d-functies / d-orbitalen hebben twee knoopvlakken die loodrecht op elkaar staan.
- f-functies / f-orbitalen hebben drie loodrecht op elkaar staande knoopvlakken.
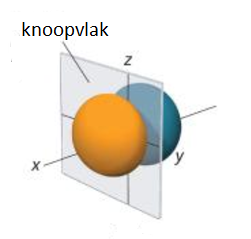
Een knoopvlak een denkbeeldig vlak in een orbitaal waar de waarschijnlijkheid om een elektron aan te treffen nul is.
Impulsmoment, of draai-impuls, is de "hoeveelheid draaiing" van een object. Impuls is de "hoeveelheid beweging", die samenhangt met de snelheid en massa van een object (in het Engels 'momentum').
Te vergelijken met het behoud van impulsmoment bij kunstschaatsers: Wanneer een kunstschaatser een pirouette uitvoert, begint deze vaak met de armen wijd uitgestrekt. Zodra de schaatser de armen intrekt, versnelt de rotatie aanzienlijk. Dit is een direct resultaat van het behoud van impulsmoment: als de afstand van de armen tot het rotatiecentrum afneemt, neemt de rotatiesnelheid toe.
Alvorens de quantumgetallen te behandelen, is het nuttig eerst te kijken naar het gebruik van s, p, d en f orbitalen in het periodiek systeem.
Het moderne periodieke systeem ordent alle bekende elementen zodanig dat elementen met vergelijkbare eigenschappen samen worden gegroepeerd. Laten we de verschillende blokken bekijken.
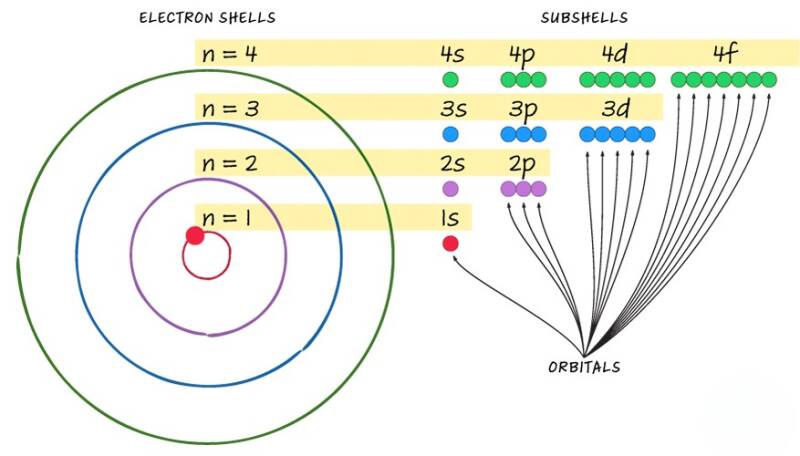
Elementen kunnen, afhankelijk van het type orbitaal waar hun valentie-elektronen zich bevinden, worden ingedeeld in vier blokken: s-blok, p-blok, d-blok en f-blok.
In het s-blok wordt de s-subschil opgevuld.
In het p-blok wordt de p-subschil opgevuld.
In het d-blok wordt de d-subschil opgevuld.
In het f- blok wordt de f-subschil opgevuld.
Binnen elke subschil worden elektronen gegroepeerd in orbitalen.
De vorm van een orbitaal is afhankelijk van diverse quantumgetallen, welke overeenkomen met een specifieke energie. In de quantumfysica zijn deze getallen cruciaal voor het omschrijven van de specifieke toestand waarin een fysisch systeem, zoals een orbitaal, verkeert.
Er zijn vier soorten quantumgetallen
- het hoofd-quantumgetal n
- het neven quantumgetal ℓ (kleine letter L) ook wel hoek-quantumgetal of Azimutaal genoemd
- het magnetisch quantumgetal m
- Het spin-quantumgetal s beschrijft de oriëntatie van de spin van een elektron. De oriëntatie van de spin langs een bepaalde as kan worden uitgedrukt als de som van twee mogelijke toestanden: spin omhoog of spin omlaag. Dit wordt bepaald door het magnetische spinkwantumgetal, aangeduid met
Op basis van de eerste drie quantumgetallen kan worden bepaald in wélke ‘sfeer’ , in welke orbitaal rond de kern het elektron zich bevindt. Het vierde quantumgetal geeft informatie over de rotatie van het elektron rond zijn eigen as.
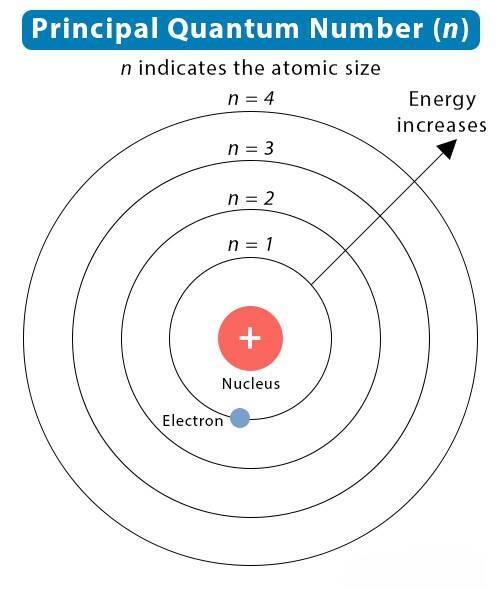
Het hoofdkwantumgetal
Het belangrijkste quantumgetal (n) is verantwoordelijk voor de energie van het elektron, en heeft waarden van opeenvolgende getallen, meestal varieert n van n 1 tot n 7. Het maximaal aantal elektronen dat per schil kan aanwezig zijn bedraagt 2n2
Dat betekent concreet het volgende:
Op de eerste schil (n=1) maximum 2x12 = 2 elektronen
Op de tweede schil (n=2) maximum 2x22 = 8 elektronen
Op de derde schil (n=3) maximum 2x32 = 18 elektronen
Op de vierde schil (n=4) maximum 2x42 = 32 elektronen
Het neven quantumgetal
Het neven kwantumgetal bepaalt de vorm van het orbitaal van een atoom.
Orbitalen kunnen worden beschreven als bolvormig, haltervormig of klaverbladvormig en kunnen zelfs nog complexere vormen aannemen. De vorm van een orbitaal wordt bepaald door de waarde van het nevenkwantumgetal: 0, 1 of 2, die de energieniveaus nader specificeert. Een s-orbitaal heeft minder energie dan een p-orbitaal.
Het nevenkwantumgetal verdeelt de hoofdschillen in subschillen, die worden aangeduid met de letters s, p, d en f, toegevoegd aan het hoofdkwantumgetal n
Magnetisch kwantumgetal
Het magnetische kwantumgetal, aangeduid met m bepaalt voornamelijk het aantal orbitalen en hun oriëntatie binnen een specifieke subschil. Het hangt af van het baanimpulsmoment en beschrijft de grootte van de spin, oftewel de 'draaiing' van een elektron.
Het spin quantumgetal
Het spin quantumgetal van het elektron beschrijft de oriëntatie van de spin van het elektron aangeduid als ms
Elektronen draaien niet écht rond hun as - ze gedragen zich alleen zo. Elektronen bezitten een impulsmoment, wat de neiging van een object aanduidt om te blijven roteren, vergelijkbaar met een draaiend fietswiel of een pirouetterende schaatser. Deze eigenschap suggereert dat elektronen draaien. Bijkomend bewijs hiervoor is dat elektronen zich manifesteren als kleine magneten, en magnetische velden worden gegenereerd door de rotatie van geladen deeltjes.
Elke orbitaal kan maximaal twee elektronen bevatten, waarbij één elektron een spin van +1/2 heeft en het andere een spin van -1/2. Wanneer twee elektronen zich in dezelfde orbitaal bevinden, hebben ze tegengestelde impulsmomenten. Het invoeren van het spin quantumgetal maakt het mogelijk dat twee elektronen dezelfde orbitaal delen, op voorwaarde dat één elektron een spin-up heeft en het andere een spin-down. Dit is in overeenstemming met het uitsluitingsprincipe van Pauli, dat voorschrijft dat geen twee elektronen in eenzelfde atoom identieke waarden voor alle vier kwantumgetallen kunnen bezitten. Dus, (1) een orbitaal kan door maximaal twee elektronen bezet worden en (2) deze twee elektronen moeten tegengestelde spins hebben.
Het spingetal beschrijft hoeveel symmetrische facetten een deeltje heeft in één volledige omwenteling: een draai van 1/2 betekent dat het deeltje twee volledige slagen moet worden gedraaid voordat het dezelfde configuratie heeft als toen het begon.
Het Aufbau-principe is de regel dat elektronen de laagste energieniveaus eerst opvullen om de elektronenconfiguratie van een atoom te bepalen. De elektronenconfiguratie beschrijft de verdeling van deze elektronen over de verschillende schillen en subschillen rond de atoomkern,

De Oostenrijkse natuurkundige Erwin Schrödinger beschreef de beweging van elektronen met golvingen in de elektronenwolk.
De elektronenconfiguratie van een atoom geeft aan hoe de elektronen verdeeld zijn in banen rondom de kern van het atoom. Het woord 'baan' is hier echter 'n beetje misleidend, omdat het elektron zich ook als een golfverschijnsel gedraagt. Toch is het handig om van banen te spreken. Voor iedere golvende baan beschrijft een wiskundige formule de waarschijnlijkheid om het elektron ergens aan te treffen. Elke baan heeft een bepaald energieniveau ten opzichte van de kern en worden van binnenuit het eerst opgevuld In het algemeen geldt: hoe verder van de kern, hoe hoger het energieniveau, maar de elektronen beïnvloeden ook elkaar omdat ze geladen deeltjes zijn.
Regels voor het samenstellen van elektronenconfiguraties.
In een atoom worden elektronen eerst geplaatst in de binnenste schil, die het laagste energieniveau heeft. Ze vullen de schillen in de volgorde van s-, p-, d- en f-subschillen (ook wel orbitalen genoemd). Naarmate je van s naar p, vervolgens naar d en f gaat, neemt het energieniveau steeds verder toe.
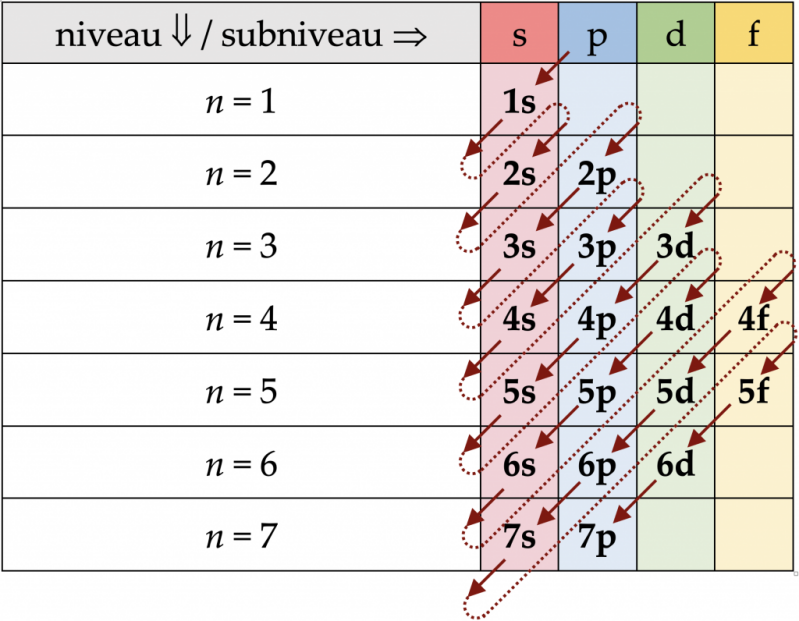
Elektronen neigen ernaar om de laagst mogelijke energiestatus aan te nemen, dat wil zeggen, een ontspannen toestand. Voor een atoom is dit de grondtoestand. Men zou verwachten dat elektronen onmiddellijk alle lagere niveaus volledig vullen. Echter, de aanwezigheid van andere elektronen maakt het proces gecompliceerder. Om de fundamentele principes van het toevoegen van elektronen aan atomaire orbitalen te begrijpen, is het opbouwprincipe ontwikkeld.
Voor de opbouw volgt je de pijlrichting
Interactieve opvulregel – GeoGebra
In de grondtoestand neemt een elektron altijd het laagst beschikbare energieniveau in. Subniveaus met een hogere energie worden alleen bezet nadat de subniveaus met een lagere energie volledig zijn gevuld.
Er is echter een 'geraffineerd energietrucje': in de derde schil ligt de energie van de p-subschil (het p-orbitaal) lager dan die van de s-subschil (het s-orbitaal). De subschil met de laagste energie wordt altijd als eerste opgevuld.
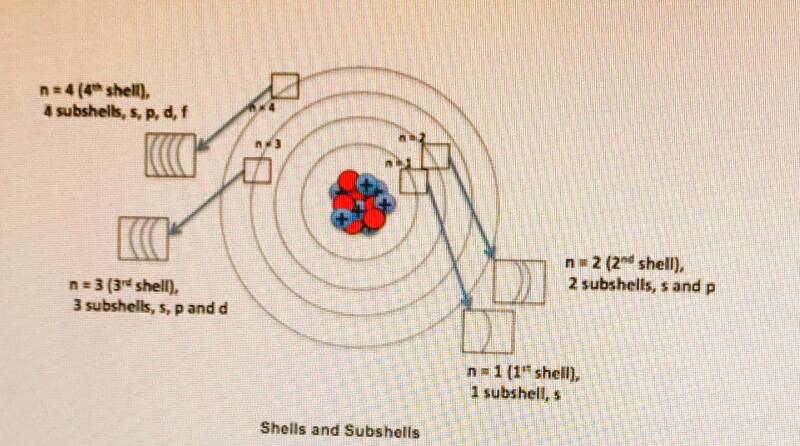
- De binnenste schil (n=1) heeft alleen een s-orbitaal.
- De tweede schil (n=2) heeft een s-orbitaal en een p-orbitaal.
- De derde schil (n=3) heeft s, p, d orbitalen.
- Vanaf de vierde schil (n>=4) zijn er s, p, d, f orbitalen.
Elke orbitaal heeft een vast aantal elektronen.
- s Orbitaal kan 2 elektronen bevatten.
- p Orbitaal kan 6 elektronen bevatten.
- d Orbitaal kan 10 elektronen bevatten.
- f Orbitaal kan 14 elektronen bevatten.
De elektronenconfiguratie van een atoom is een numerieke representatie van zijn elektronenorbitalen. Ter herinnering: elektronenorbitalen zijn verschillend gevormde gebieden rond de kern van een atoom waar wiskundig gezien een significante kans is om elektronen aan te treffen.
Uit de elektronenconfiguratie kan men snel en eenvoudig opmaken hoeveel elektronenorbitalen een atoom bezit en hoeveel elektronen er in elke orbitaal zitten.
-
s-orbitaal: Dit type orbitaal heeft één enkele orbitaal en wordt aangeduid met een “s” in de elektronconfiguratie. Volgens het Uitsluitingsprincipe van Pauli kan een enkele orbitaal maximaal 2 elektronen bevatten.
-
p-orbitaal: De p-orbitaal bevat 3 orbitalen en kan dus in totaal 6 elektronen bevatten.
-
d-orbitaal: Deze orbitaal bevat 5 orbitalen en kan maximaal 10 elektronen bevatten.
-
f-orbitaal: De f-orbitaal heeft 7 orbitalen en kan daardoor 14 elektronen bevatten.
Mij viel iets op bij de elektonenconfiguratie van het 3e element, Lithium.
Twee van de lithiumelektronen passen in de orbitaal 1s, maar het derde elektron moet in de tweede schil met lagere energie, de orbitaal 2s. Ik dacht dat de energie van de schil toenam met de verdere afstand tot de kern…..
De orbitaal 1s kan maximaal 2 elektronen bevatten, dus de elektronenconfiguratie voor een lithiumatoom, dat drie elektronen heeft, kan niet 1s3 zijn. Twee van de 3 lithiumelektronen passen in de orbitaal 1s, maar het derde elektron gaat toch in de tweede schil. Daarom schrijven we de elektronenconfiguratie van een lithiumatoom als 1s22s1
De tweede schil heeft een lagere energie. Dit is de reden waarom de energie lager is:
De elektronenschillen worden, gerekend vanaf de kern, aangeduid als: K-, L-, M-schil, enz. Men spreekt ook wel van de eerste, tweede, derde enz. en geeft dit aan met n = 1 (K-schil), n = 2 (L-schil), enz
In de context van atomen verwijst een “schil” naar een energieniveau waarop elektronen zich bevinden. Elk energieniveau heeft een specifiek aantal orbitalen waarin elektronen kunnen zitten. Hier zijn enkele belangrijke punten:
- K-schil (eerste schil): Dit is het laagste energieniveau en bevat maximaal 2 elektronen in de 1s-orbitalen. De 1s-orbitalen zijn het dichtst bij de kern en hebben de laagste energie.
- L-schil (tweede schil): Dit is het volgende energieniveau. Hier bevindt zich één elektron in de 2s-orbitaal.
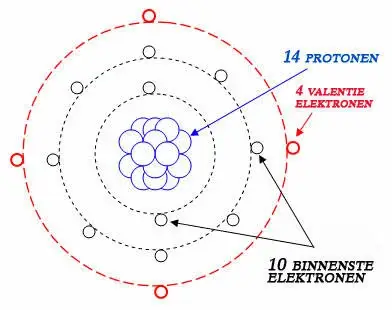
Het afschermende effect verwijst naar de afname van de aantrekkingskracht van de kern op elektronen in de bovenste schil, valentie-elektronen, als gevolg van de aanwezigheid van elektronen in de binnenste schil.
De afbeelding links toont de eerste vier energieniveaus van een atoom. Elektronen in energieniveau 1 = energieniveau K, hebben de minste hoeveelheid energie. Dit komt omdat de aantrekkingskracht tussen de kern en de elektronen maximaal is. De aantrekkingskracht neemt af naarmate de afstand tot de kern toeneemt, hierdoor neemt de energie van de elektronen toe met een vaste maar beperkte hoeveelheid. De afbeelding rechts, is het kwantum atoommodel van Bohr met een overeenkomstige definiëring.
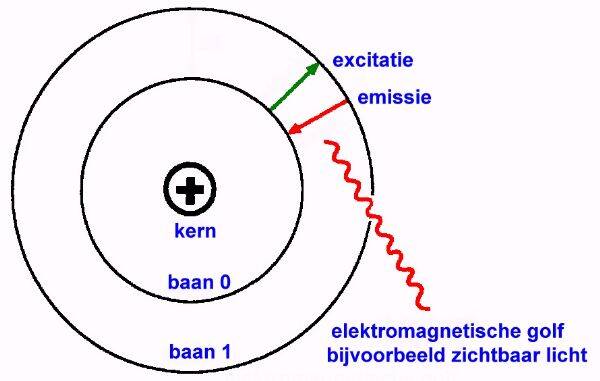
Elektronen kunnen van een lager naar het volgende hogere energieniveau springen als ze deze hoeveelheid energie absorberen. Omgekeerd, als elektronen van een hoger naar een lager energieniveau springen, geven ze energie af: zo ontstaat licht.
Een energieniveau in een atoom wordt beschreven als de energie die een elektron heeft die zich boven de grondtoestand bevindt. Elk elektron zal in een energieniveau in de grondtoestand bestaan, n=1, totdat het aangeslagen wordt en energie krijgt, dan kan het naar verschillende energieniveaus gaan.
- Elektronen worden aangeslagen wanneer een atoom een bepaalde hoeveelheid energie absorbeert, bijvoorbeeld door straling. Hierdoor kan een elektron van een lagere naar een hogere baan springen, waardoor het in een hogere energietoestand komt, zoals van baan 1 naar baan 2 oftewel met de kwantumnummers: van n = 2 naar n = 3.
In het diagram hieronder worden de energiewaarden van de verschillende niveaus weergegeven door horizontale lijnen, met het laagste niveau (de grondtoestand) onderaan en het hoogste niveau (ionisatie) bovenaan.
Bron: levelphysicstutor.com
Voor een wetenschappelijke uitleg kan ik het beste de volgende link plaatsen:
De grondtoestand vertegenwoordigt het laagste energieniveau, terwijl ionisatie het hoogste niveau aangeeft. Men zou kunnen verwachten dat de grondtoestand nul energie heeft, maar dat is niet zo. Het minteken betekent niet dat de energie negatief is.
Een energie van -13,6 eV betekent dat er 13,6 eV nodig is om een elektron te ioniseren, dat wil zeggen, om het elektron uit het atoom te verwijderen en het atoom te ioniseren. Het is interessant om op te merken dat 1 eV gelijkstaat aan 1,6 × 10−19Joule.
De grondtoestandsenergieën van de eerste 10 elementen:
Waterstof (H): -13.60 eV
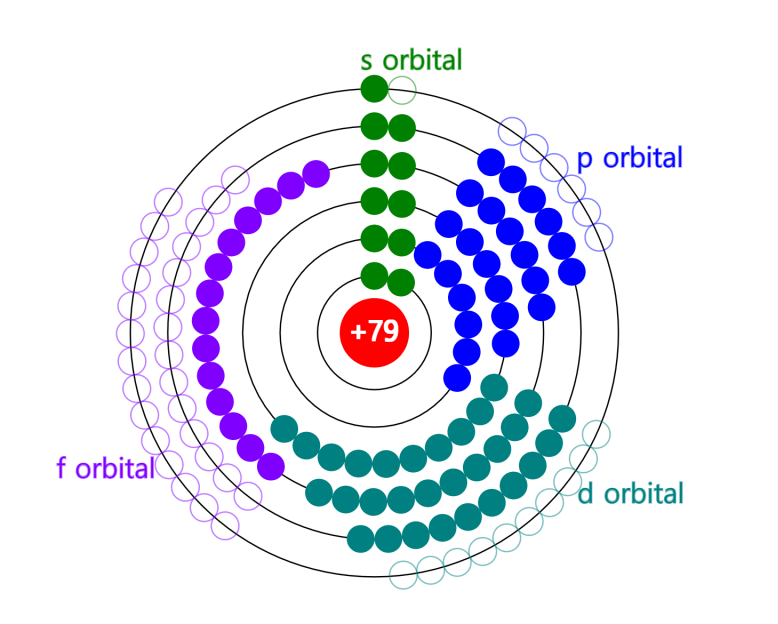
Helium (He): -79.0 eV
Lithium (Li): -5.39 eV
Beryllium (Be): -9.32 eV
Boor (B): -8.30 eV
Koolstof (C): -11.26 eV
Stikstof (N): -14.53 eV
Zuurstof (O): -13.62 eV
Fluor (F): -17.42 eV
Neon (Ne): -21.56 eV
- Opmerking bij Helium: De energie die nodig is om beide elektronen uit het heliumatoom in zijn grondtoestand te verwijderen, is 79.0 eV.
- De grondtoestandsenergieën van atomen zijn niet altijd oplopend. Dit komt door de complexe interacties tussen elektronen en de kern van het atoom.
Ionisatie energieën van de eerste 10 elementen
Waterstof 13.60 eV
Helium 24.58 eV
Lithium 5.39 eV
Beryllium 9.32 eV
Boor 8.30 eV
Koolstof 11.26 eV
Stikstof 14.53 eV
Zuurstof 13.62 eV
Fluor 17.42 eV
Neon 21.56 eV
- Helium heeft een hogere nucleaire lading en een kleinere atoomstraal dan waterstof. De grootte van de kracht die op elk elektron helium inwerkt, is dus groter. Er is dus een grotere hoeveelheid energie nodig om het valentie-elektron uit te schakelen. De ionisatie-energie van helium is dus groter dan die van waterstof.
Energieniveaus staan voor de elektronenschillen rondom de kern van een atoom, op bepaalde afstanden waar elektronen zich kunnen bevinden. Elektronen mogen zich wel op deze niveaus bevinden, maar niet in de ruimtes daartussen. Elektronen "draaien" om de atoomkern en kunnen verschillende energieniveaus bezitten. Hoe hoger het energieniveau van een elektron, hoe losser de verbinding met de atoomkern. Maar elektronen "draaien" niet in vaste banen rond het centrum van een atoom bewegen, in tegenstelling tot planeten rond de zon.
Ik zet 'draaien' tussen aanhalingstekens omdat elektronen niet echt draaien, maar zich als een golf verspreiden. Al eerder gaf ik dit aan bij elektronspin. Bovendien beweegt een elektron in een stabiele atomaire toestand niet in de zin van zwaaien door de ruimte. Elektronen verplaatsen zich en 'volgen stappen in de tijd' die vastgelegd kunnen worden met de wiskundige vergelijking van Erwin Schrödinger. Je zou elektronen kunnen vergelijken met een zwerm bijen of vogels: hun individuele bewegingen zijn te snel om te volgen, maar je ziet wel hoe de volledige zwerm beweegt. Het orbitale elektron beweegt zich dus in termen van golven en trillingen door de tijd.
Orbitale elektronen
De elektronen in een atoom zijn gerangschikt in schillen die de kern omringen, waarbij elke opeenvolgende schil verder van de kern verwijderd is. Elektronenschillen zijn opgebouwd uit één of meerdere subschillen, en deze subschillen bevatten op hun beurt één of meer atomaire orbitalen. Elektronen binnen dezelfde subschil bezitten identieke energieniveaus, maar elektronen in verschillende schillen of subschillen hebben uiteenlopende energieën.
Je zou je kunnen afvragen hoe snel elektronen door atomen bewegen. Een duidelijk voorbeeld, en het gemakkelijkst te berekenen, is het waterstofatoom dat in al ons water voorkomt. Uit berekeningen blijkt dat het elektron zich met een snelheid van ongeveer 2.200 kilometer per seconde verplaatst, wat minder is dan 1% van de lichtsnelheid. Dan krijg je een idee van de waarschijnlijkheid om een elektron ergens aan te treffen..........
Wat zijn valentie-elektronen? Waarom zijn ze belangrijk?
Valentie-elektronen bevinden zich in de buitenste schil van een atoom. Omdat ze het verst van de kern verwijderd zijn en daardoor het minst stevig vastgehouden worden, zijn het deze elektronen die betrokken zijn bij chemische bindingen en reacties. Het aantal valentie-elektronen van een element bepaalt mede de reactiviteit, elektronegativiteit en het aantal mogelijke bindingen dat het kan aangaan.
- Elektronegativiteit is een maat voor de kracht waarmee een atoom elektronen naar zich toe trekt. Hoe hoger de elektronegativiteit, des te sterker is de aantrekkingskracht van een atoom op elektronen.
De term 'valentie' duidt op het vermogen van een element om verbindingen aan te gaan met andere atomen. Historisch gezien werd de valentie van een element bepaald door het aantal waterstofatomen waarmee het zich kon binden, wat weer afhangt van het aantal beschikbare valentie-elektronen: zo kan koolstof CH4 vormen, wat betekent dat het een valentie van 4 heeft en dus over 4 valentie-elektronen beschikt. Stikstof kan NH3 vormen, wat aangeeft dat het een valentie van 3 heeft met 3 valentie-elektronen.
Hoe zijn atomen aan elkaar gebonden?
Twee atomen kunnen - in hoofdzaak - op 2 manieren aan elkaar gebonden zijn:
- Covalent: Twee atomen delen een aantal elektronen en vormen zo een bindend gemeenschappelijk elektronenpaar.
- Ionisch: Het ene atoom staat één of meerdere elektronen af aan het andere atoom, waardoor ionen ontstaan die bij elkaar blijven door elektrostatische aantrekking.
In beide gevallen bereiken de atomen een octetconfiguratie: ze streven ernaar te combineren op een manier die elk van hen acht elektronen in de buitenste schil geeft, net zoals edelgassen dat hebben.
Covalente bindingen worden in de kwantumfysica beschreven als een verandering in de toegestane energieniveaus wanneer atomen elkaar naderen. De elektrische ladingen van de elektronen en de kern van het ene atoom beïnvloeden het andere atoom, waardoor sommige energieniveaus stijgen en andere dalen. Een covalente binding treedt op wanneer bezette energieniveaus verlagen, wat betekent dat het energie zou vereisen om de atomen weer te scheiden.
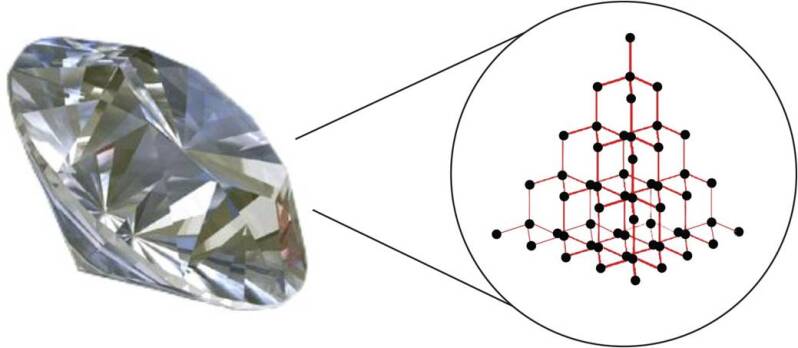
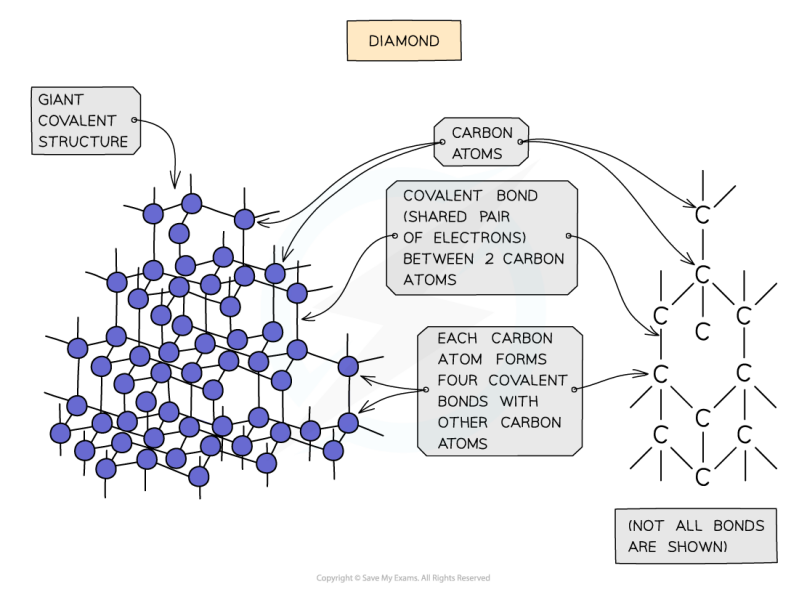
Een voorbeeld van een covalente binding is diamant.
In diamant is koolstof gekoppeld aan 4 andere koolstofatomen. De molecuulformule van diamant is C omdat het alleen uit koolstofatomen bestaat.
wordt vervolgd
Ionische bindingen en elektronengolven
Bij ionische bindingen worden elektronen niet gedeeld tussen atomen, zoals bij covalente bindingen, maar worden ze volledig overgedragen van het ene atoom naar het andere. Dit leidt tot de vorming van kationen en anionen, die elkaar aantrekken door elektrostatische krachten. Toch spelen de golfkarakteristieken van elektronen nog steeds een rol op een meer fundamenteel niveau.
- Tijdens chemische reacties kan een atoom een elektron verliezen of juist een elektron opnemen van een ander atoom. Wanneer dit plaatsvindt, is het atoom niet langer neutraal maar geladen, en verandert het in een ion. Als een ion positief geladen is, noemt men het een kation; als het negatief geladen is, een anion.
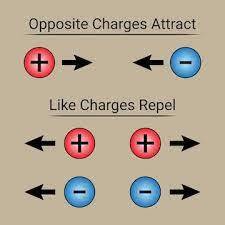
Elektrostatische kracht.
- Wanneer twee positieve ladingen of twee negatieve ladingen worden samengebracht, dan stoten de twee ladingen elkaar af.
- Wanneer twee tegengestelde ladingen worden samengebracht, worden twee ladingen naar elkaar toe getrokken
Rol van elektronengolven: Zelfs wanneer elektronen volledig zijn overgedragen, bepalen hun golffuncties de verdeling van lading rond de ionen, wat invloed heeft op de potentiële energie en de stabiliteit van de ionische kristalstructuur.
- De potentiële energie van een ionische kristalstructuur is de energie die opgeslagen is door de elektrostatische interacties tussen de ionen in het kristal.
ionische verbindingen
Ionische verbindingen kunnen worden gedefinieerd als:
- De kristallijne vaste stoffen worden gevormd door netjes opeengepakte ionen met tegengestelde lading. Ionische verbindingen worden meestal gevormd wanneer metalen reageren met niet-metalen.
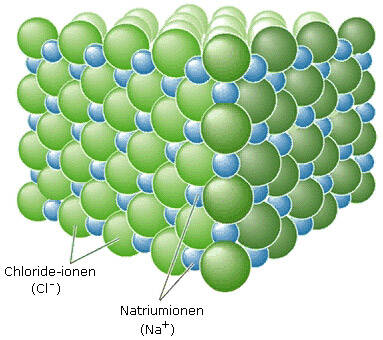
Natriumchloride is bekend als een typische ionische verbinding. Deze verbindingen bestaan uit een groot, zich oneindig herhalend rooster van ionen. Daarom karakteriseert men natriumchloride, net als andere ionische verbindingen, als een uitgebreide ionische structuur.
Natriumchloride is het keukenzout dat we allemaal kennen. NaCl is de 'simpele scheikundige formule' die we dagelijks tot ons nemen: 39,5 % natrium en 60,5 % chloride.
Het bestaat uit positief geladen natriumionen Na+ en negatief geladen chloride-ionen Cl-
Gerelateerd aan ionische binding vanuit het perspectief van kwantumfysica:
- Quantumfysica beschrijft ionische bindingen als het resultaat van elektrostatische interacties tussen positief geladen kationen en negatief geladen anionen. Volgens deze theorie bezetten elektronen in atomen specifieke energieniveaus, bekend als orbitalen. Wanneer twee atomen samenkomen om een ionische binding te vormen, worden elektronen overgedragen tussen de atomen om een stabielere configuratie te verkrijgen.
- Elektronenschillen, of energieniveaus, zijn cruciaal voor ionische bindingen. In kwantumfysica zijn elektronen georganiseerd in schillen rond de kern, waarbij de elektronen in de buitenste schil de chemische eigenschappen van een atoom bepalen. Tijdens de vorming van een ionische binding worden de buitenste elektronen van het ene atoom overgedragen naar de buitenste schil van een ander atoom, resulterend in de vorming van ionen en de daaropvolgende binding.
- Kwantumtunneling maakt het mogelijk voor elektronen om tussen energieniveaus te 'springen' zonder de tussenliggende energiebarrière te passeren. In het geval van ionische bindingen betekent dit dat elektronen gemakkelijk kunnen overgaan van het ene atoom naar het andere, zelfs als ze niet de energie hebben om de elektrostatische afstoting te overwinnen, wat essentieel is voor de vorming en stabiliteit van ionische bindingen.
- Quantumfysica biedt inzicht in de sterkte van ionische bindingen, die afhangt van het verschil in elektronegativiteit tussen de betrokken atomen. Elektronegativiteit is de maat voor hoe sterk een atoom elektronen aantrekt. Dit hangt samen met de elektronenaffiniteit, de energie die vrijkomt wanneer een atoom een elektron opneemt. Deze factoren worden beïnvloed door de configuraties van elektronen en hun energieniveaus. Zo wordt de kracht van een ionische binding uiteindelijk bepaald door de kwantummechanische eigenschappen van de atomen.
- Hoewel quantumfysica essentieel is voor het verklaren van ionische bindingen, zijn er ook andere factoren die de sterkte en stabiliteit ervan kunnen beïnvloeden. De grootte en lading van ionen, alsook de kristalstructuur waarin ze zich bevinden, kunnen de sterkte van de binding beïnvloeden. Externe factoren zoals temperatuur en druk kunnen eveneens een impact hebben op de stabiliteit van ionische bindingen.
Atomen zijn verwikkeld in een 'atomair schouwspel' dat alleen via de quantumfysica zichtbaar wordt. Ze reageren uitsluitend met elkaar om een stabielere configuratie te verkrijgen, met als doel hun buitenste elektronenschillen te vullen, en verder niets!
Atomen voelen zich het meest stabiel, het meest 'ontspannen' wanneer hun buitenste elektronenschil vol is. Dit betekent wetenschappelijk dat ze de elektronenconfiguratie van een edelgas hebben bereikt, wat ze wel degelijk 'ervaren'. Dan is er geen noodzaak meer om verbindingen met andere elementen aan te gaan, wat zorgt voor rust...........
Quantumfysica biedt de enige uitleg en voorspelling voor dit atomaire schouwspel dat zich al meer dan 14 miljard jaar voltrekt. Dit heeft geleid tot een universum met ongeveer honderd miljard sterrenstelsels, elk met honderden miljarden sterren en miljarden planeten. De Aarde is maar één van die vele miljarden, en wij kennen op deze planeet een oneindige verscheidenheid aan verbindingen.
Ik wil afsluiten met een kleurrijk quantumfysisch verschijnsel .
Poollicht is een natuurkundig fenomeen dat optreedt wanneer energierijke deeltjes van de Zon in botsing komen met atomen en moleculen in de atmosfeer van de Aarde. Bij deze botsingen raken atomen en moleculen aangeslagen, waardoor ze energie opnemen. Die energie komt vervolgens vrij als zichtbaar licht. Dit proces van opnemen en uitzenden is een basisprincipe van de quantumfysica.
- De Zon: Stoot geladen deeltjes uit.
- Aardmagnetisch veld: Leidt deze deeltjes naar de polen.
- Botsingen: De deeltjes botsen met stikstof- en zuurstofatomen en -moleculen in de atmosfeer.
- Het quantumfysisch proces: atomen en moleculen worden aangeslagen (ze krijgen extra energie) en zenden die energie vervolgens uit als fotonen, wat wij waarnemen als het poollicht.