In een eerdere Verdieping heb ik uitgelegd hoe elementen zijn ontstaan. Nu wil ik ingaan op de elementen en hun isotopen die belangrijk zijn voor het ontstaan van leven, en informatie geven over de verschillende isotopen van die elementen, zoals hun stabiliteit (stabiel of instabiel), verval en halfwaardetijd. De lichtste elementen en hun isotopen worden in sterren gevormd, de zwaardere elementen tijdens een supernova-explosie. Elementen worden 'zwaar' genoemd omdat ze een groot aantal kerndeeltjes hebben (hoog massagetal), wat mede komt door een overschot aan neutronen ten opzichte van protonen.
Al deze elementen en hun isotopen komen terecht in enorme gas- en stofwolken, die zich in de loop van miljoenen jaren door het universum verspreiden.
De stabiliteit van een ster begint in de ster zelf. Een ster vereist nou eenmaal, net als een organisme, een continue energievoorziening om haar stabiliteit te behouden. Kernfusie is het proces dat een ster van energie voorziet en ervoor zorgt dat die stabiel blijft.
In de meeste actieve sterren, zoals de Zon, worden waterstofkernen onder immense druk en hoge temperaturen samengeperst tot heliumkernen. Bij deze fusie komt een enorme hoeveelheid energie vrij in de vorm van warmte- en lichtstraling. Deze naar buiten gerichte stralingsdruk, veroorzaakt door de vrijkomende energie, balanceert perfect de naar binnen gerichte zwaartekracht van de enorme massa van de ster. Dit evenwicht, bekend als hydrostatisch evenwicht, zorgt ervoor dat de ster niet verder instort of explodeert, waardoor deze "stabiel" blijft gedurende miljoenen tot miljarden jaren.
Hoewel een ster het evenwicht niet "voelt", is haar bestaan en stabiliteit het directe gevolg van het constant nastreven en herstellen van dit hydrostatische evenwicht door de wetten van de fysica. Het is een toestand van dynamische balans die constant wordt gehandhaafd door de interactie van de materie waaruit de ster is opgebouwd.
Het zijn de wetten van de fysica die zorgen voor het voortdurend nastreven en herstellen van het hydrostatische evenwicht van een ster. Welke wetten zijn dat?
Het constant nastreven en herstellen van het hydrostatische evenwicht van een ster wordt geregeld door een samenspel van de volgende fundamentele natuurkundige wetten en principes:
- Newtons universele zwaartekrachtswet is de basis van de naar binnen gerichte kracht. De wet stelt dat elke massa een aantrekkingskracht uitoefent op elke andere massa. In een ster zorgt de immense, geconcentreerde massa ervoor dat elk deeltje plasma constant naar het centrum wordt getrokken. Deze wet bepaalt hoe sterk de ster door zijn eigen gewicht wordt samengedrukt.
- De ideale gaswet beschrijft hoe het gas, oftewel plasma, in een ster zich gedraagt. Wanneer zwaartekracht het gas samendrukt, wordt het volume kleiner en nemen dichtheid en temperatuur toe, waardoor de druk stijgt. Die hogere druk vormt de tegenkracht die de zwaartekracht in balans houdt. De energie die vrijkomt bij kernfusie in de kern wordt efficiënt naar buiten getransporteerd, waardoor de hoge temperatuur en druk behouden blijven. Via straling en convectie wordt de energie verspreid, wat zorgt voor een uitwaartse stralingsdruk. Dit proces is cruciaal om de warmte af te voeren en het temperatuurverloop in stand te houden.
- Nucleosynthese: het proces waarbij zwaardere chemische elementen ontstaan uit lichtere, door de versmelting van atoomkernen. Het is een fusiereactie waarbij waterstof in helium wordt omgezet, en vormt de ‘motor’ van de ster. De snelheid van deze reacties is enorm gevoelig voor temperatuur en dichtheid: als de ster iets krimpt, stijgt de kerntemperatuur en neemt de fusiesnelheid exponentieel toe, waardoor extra druk ontstaat die de krimp stopt. Zet de ster iets uit, dan daalt de temperatuur, vermindert de fusiesnelheid en neemt de druk af, waardoor de zwaartekracht weer de overhand krijgt en de ster zich stabiliseert.
De eerste lichte elementen ontstaan door kernfusie in sterren, bekend als nucleosynthese. De overige zwaardere elementen door neutronenvangst bij supernova's. Elektronenvangst speelt ook een belangrijke rol bij nucleosynthese. Het is niet direct een proces dat nieuwe, zwaardere elementen vormt, maar eerder een mechanisme dat de omstandigheden voor nucleosynthese beïnvloedt en bepaalde isotopen kan aanmaken of afbreken. Later meer over elektronenvangst.
In de video 'Stellar Nucleosynthesis' zagen we het proces van nucleosynthese waarbij zwaardere atoomkernen worden gevormd uit lichtere atoomkernen. Een supernova is een explosieve gebeurtenis die dit proces mogelijk maakt. Tijdens een supernova-explosie zorgen de extreem hoge temperaturen en druk ervoor dat er een zeer kortstondige maar uiterst krachtige nucleosynthese plaatsvindt, die de creatie van elementen zwaarder dan ijzer mogelijk maakt.
De supernova die de Krabnevel deed ontstaan, was een explosie in jaar 1054, die door astronomen werd waargenomen als een "gastster" die 23 dagen lang overdag zichtbaar was. Deze supernova wordt aangeduid als Messier 1 of ook SN 1054. De overblijfselen ervan, de Krabnevel, zijn de restanten van de explosie.
Na de supernova in 1054 stortte de kern van de oorspronkelijke ster in tot een extreem dicht object, een neutronenster, dat grotendeels uit neutronen bestaat. Dit object, de Krabpulsar, draait 30 keer per seconde rond en zendt bundels elektromagnetische straling uit.
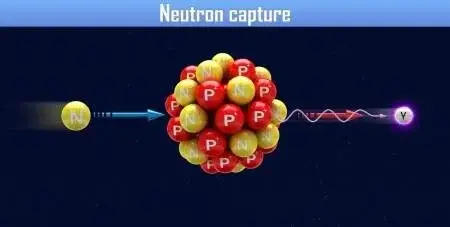
Supernova's zijn van wezenlijk belang voor de productie van veel van de zwaardere en neutronenrijke elementen via processen als neutronenvangst. Hier ga ik wat dieper op in omdat het aantal neutronen cruciaal is voor het verschil tussen atomen en dus ook isotopen. Het aantal neutronen ten opzichte van het aantal protonen bepaalt of een atoomkern stabiel of instabiel is. Als een atoomkern te veel neutronen of protonen heeft, wordt deze instabiel en kan vervallen door radioactieve straling uit te zenden totdat er een stabiele toestand wordt bereikt. Bovendien, en dat zal wel duidelijk zijn, kan het aantal neutronen in de atoomkern variëren, waardoor er verschillende isotopen van hetzelfde element ontstaan.
Tijdens een supernova worden grote hoeveelheden neutronen geproduceerd door middel van het proces dat bekend staat als neutronenvangst. Dit proces vindt plaats binnenin de intense omgeving van de supernova-explosie en is cruciaal voor de vorming van veel elementen zwaarder dan ijzer.
Neutronenvangst
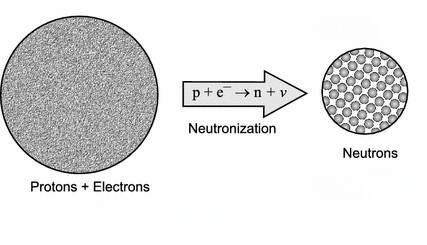
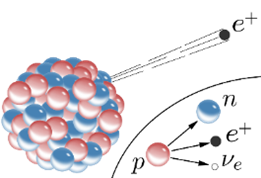
Neutronisatie is hierin een belangrijk proces dat plaatsvindt tijdens de kerninstorting van een zware ster, wat uiteindelijk leidt tot een supernova-explosie en de vorming van een neutronenster. Onder de extreme druk en temperatuur in de instortende sterkern worden de atoomkernen zó dicht op elkaar geperst dat de normale atoomstructuren bezwijken. Elektronen worden met zulke kracht in de protonen van de atoomkernen gedrukt dat ze fuseren.
Dit proces vindt plaats in de kernen van massieve sterren tijdens een supernova-explosie, wat resulteert in de vorming van een neutronenster.
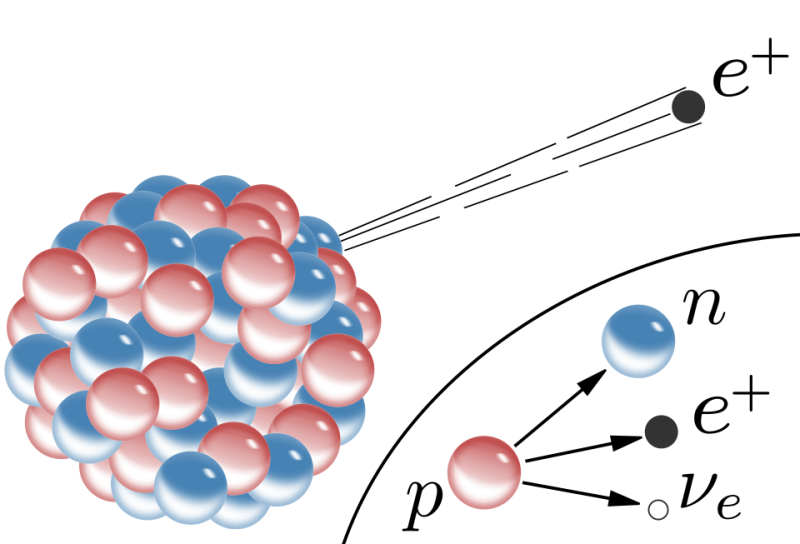
Onder extreme druk en temperatuur worden protonen en elektronen samengeperst tot neutronen, waarbij neutrino’s vrijkomen. Deze neutronen spelen een sleutelrol bij het ontstaan van zware elementen, vooral via een zo genoemde 'snelle neutronenvangst'.
Het r-proces (rapid) en het s-proces (slow) bij neutronenvangst
Het r-proces is sneller in het invangen van neutronen, maar het levert extreem instabiele isotopen op die pas later stabiel worden.
Het s-proces is langzamer in het invangen, maar de isotopen zijn vrijwel direct stabiel, omdat bètaverval tijdens het proces plaatsvindt. Beide processen zijn essentieel voor de vorming van alle zwaardere elementen in het universum die wij waarnemen als stabiel.
Tijdens de kerninstorting (implosie) die voorafgaat aan de daadwerkelijke supernova-explosie, worden enorme hoeveelheden neutrino’s uitgestoten, die indirect verband houden met neutronen. Deze ontstaan namelijk in de kern die de explosie veroorzaakt, terwijl neutrino’s juist weten te ontsnappen. Het uitgestoten materiaal bevat zware elementen die tegelijk met de instorting en de explosie zijn ontstaan.
- Neutrino-uitbarsting: Bij dit proces komen neutrino's vrij. Ongeveer 99% van de energie die vrijkomt bij een supernova-explosie wordt via neutrino's afgevoerd, wat het aangedreven proces is dat de materie de ruimte in stuwt. Deze neutrino's ontstaan in de kern van de supernova binnen een paar seconden (meestal 10 tot 20 seconden) en spelen een cruciale rol in de explosie én de schokgolf die de buitenste lagen van de ster de ruimte in blaast.
De supernova-explosie wordt aangedreven door de overdracht van energie van enorme aantallen neutrino’s. Wanneer de kern van de ster instort, stopt het vallende materiaal plots en botst het tegen de superdichte kern van de proto-neutronenster. Deze plotselinge terugslag slingert een supersonische schokgolf naar buiten, door de rest van de ster heen. Normaal zou zo’n schokgolf snel verzwakken, maar neutrino’s die uit de hete kern ontsnappen, geven warmte af achter de schokgolf. Daardoor krijgt de schokgolf extra kracht en worden de buitenste lagen van de ster met geweld de ruimte in geslingerd.
Tijdens de explosie:
- Worden alle bestaande elementen in de ster de ruimte in geslingerd.
- Worden er door nucleosynthese (het s-proces en r-proces) tijdens de extreme hitte en druk van de explosie, naast ijzer ook zwaardere elementen zoals goud, platina en uranium gevormd.
- Vormen deze uitgestoten materialen, naarmate ze afkoelen, stofdeeltjes en gaswolken die de interstellaire materie verrijken.
Na de explosie
- Als de resterende kernmassa groter is dan ongeveer 3 zonsmassa's, stort de ster verder in tot een zwart gat.
- Als de resterende kernmassa minder is dan ongeveer 3 zonsmassa's, vormt zich een neutronenster.
De vorming van een zwart gat is een ander verhaal, maar.......
- In de extreem dichte en hete kern van de instortende ster worden protonen en elektronen samengeperst tot neutronen door middel van omgekeerd bètaverval (p + e⁻ → n + νₑ) Hierdoor ontstaat een extreem dichte, hete bal van materie, die voornamelijk uit neutronen en een enorme hoeveelheid neutrino's bestaat: allereerst ontstaat er een voorloper van een neutronenster, een proto-neutronenster. Deze fase duurt slechts enkele seconden.
De tijdschaal waarop deze kosmische catastrofes zich afspelen is duizelingwekkend en één van de meest fascinerende aspecten van supernova's. De kerninstorting zélf, het moment waarop de zwaartekracht het overneemt en de proto-neutronenster zich vormt, gebeurt binnen milliseconden tot ongeveer één seconde. Deze wetmatige processen vinden plaats sneller dan een knip van je vingers...........
De explosieve uitstoot van materie en de nucleosynthese volgt daar direct op, binnen de eerste paar seconden tot minuten.
De overgang van een traag, miljarden jaren durend bestaan naar een gebeurtenis die in minder dan een seconde wordt beslist, spreekt enorm tot de verbeelding.
Het is deze extreme snelheid en dichtheid die de unieke omstandigheden schept die nodig zijn om de zwaarste elementen in het universum te smeden.
Bron afbeelding: APOD
Elektronenvangst
Elektronenvangst is een sleutelmechanisme in stellaire evolutie en nucleaire processen, maar het werkt anders dan kernfusie of neutronenvangst. Het is een transformatieproces waarbij een proton-rijke atoomkern een elektron uit zijn schil absorbeert, waardoor een proton verandert in een neutron.
Neutrino's worden "spookdeeltjes" genoemd omdat ze vrijwel geen massa hebben, geen elektrische lading dragen en nauwelijks reageren met normale materie. Elke seconde vliegen er miljarden neutrino's door uw lichaam zonder dat u daar iets van merkt. Omdat neutrino's overal doorheen gaan, fungeren ze als kosmische boodschappers die informatie rechtstreeks uit de kern van de zon of van verre supernova's naar ons toe brengen.
Ondanks deze ongrijpbaarheid worden ze toch gemeten:
- Wetenschappers gebruiken gigantische hoeveelheden materiaal (zoals water of ijs) om de kans op een toevallige botsing te vergroten. De IceCube-detector op de Zuidpool gebruikt bijvoorbeeld een kubieke kilometer Antarctisch ijs.
Bron video: strophysics
Elektron-neutrino's evenals alle andere neutrino’s hebben geen lading, waardoor ze bijna niet te detecteren zijn en dwars door objecten heen kunnen vliegen.
Elektronenvangst-supernova
Het besproken transformatieproces kan leiden tot instabiliteit van de kernstructuur, wat uiteindelijk resulteert in een elektronenvangst-supernova.
In maart 2018 stuitten astronomen op een bijzonder type supernova, waarvan de explosie slechts drie uur eerder had plaatsgevonden, net voordat ze hun telescoop erop richtten. Dit spectaculaire einde van ster voltrok zich relatief dichtbij, op ‘maar’ 31 miljoen lichtjaar van de Aarde, in het sterrenstelsel NGC 2146.
In deze ‘middenklasse’ sterren, van gemiddelde grootte zoals onze eigen Zon, stopt de kernfusie als de kern zuurstof, neon en magnesium bevat. Er is niet genoeg druk van de zwaartekracht om het nog zwaardere ijzer te laten ontstaan. De kern bestaat dan uit een plasma: een soep van atoomkernen en vrije elektronen. Een deel van de elektronen wordt in de kernen van zuurstof-, neon- en magnesiumatomen geduwd. Die elektronenvangst geeft het laatste zetje, waardoor de kern bezwijkt en explodeert in een supernova. Deze explosie wordt een 'elektronenvangst supernova' genoemd: electron-capture supernova.
De materie om ons heen bestaat uit zo'n 118 verschillende elementen. Tot welk van deze elementen een atoom behoort, wordt bepaald door het aantal protonen (positief geladen deeltjes) en neutronen (ongeladen deeltjes) in de atoomkern. Het aantal protonen bepaalt het atoomnummer, dit is de plaats van het element in het periodiek systeem. Voor een neutraal atoom is het atoomnummer ook gelijk aan het aantal elektronen. Een neutraal atoom heeft een gelijk aantal protonen en elektronen, waardoor de totale elektrische lading nul is. Het aantal neutronen bepaalt het massagetal, dit is de som van het aantal protonen en neutronen in de kern van een atoom.
Men spreekt van isotopen wanneer twee atomen hetzelfde aantal protonen hebben, d.w.z. tot hetzelfde element behoren, maar een verschillend aantal neutronen hebben, dus een verschillend massagetal hebben.
In de wetenschap wordt onderscheid gemaakt tussen stabiele isotopen en onstabiele isotopen:
- Stabiele isotopen veranderen niet en blijven in hun vorm – ze zijn dus stabiel. Bijna elk in de natuur voorkomend element heeft ten minste één stabiele isotoop.
- Instabiele isotopen hebben een niet-stabiele atoomkern, wat betekent dat het aantal protonen en neutronen niet in evenwicht is. Deze kernen vallen spontaan uiteen door middel van radioactief verval en zenden daarbij straling uit. Het doel van dit verval is om een stabielere atoomkern te bereiken, vaak door over te gaan in een ander element of een stabielere isotoop van hetzelfde element.
Bètaverval
Bij dit verval verandert een neutron in een proton en zendt een elektron uit en een elektron-antineutrino door β- straling, óf een proton verandert in een neutron en zendt een positron en een elektron-neutrino uit door β+ straling. Het elektron-antineutrino symbool ̅νe is het antideeltje van het elektron-neutrino νe
Bètadeeltjes zijn energierijke elektronen (e−) of positronen (e+) die door bètastraling uit de kern van een atoom worden geschoten. Het is een type radioactief verval, waarbij een instabiele atoomkern verandert in een stabielere kern.
Het principe van exponentieel verval, oftewel afname met een vast percentage en een constante halveringstijd, geldt voor alle instabiele isotopen. Het is een fundamentele wetmatigheid in de kernfysica. Elk instabiel isotoop heeft 'n eigen unieke, onveranderlijke halveringstijd.
Halveringtijd
De tijdsduur m.b.t. de halveringtijd:
Als voorbeeld neem ik het al genoemde instabiele isotoop tritium waarvan het verval een halveringstijd heeft van ongeveer 12,3 jaar.
- Na de eerste 12,3 jaar: De helft van het oorspronkelijke tritium vervalt.
- Volgende 12,3 jaar: De helft van de overgebleven hoeveelheid vervalt, wat neerkomt op 1/4 van het oorspronkelijke tritium.
- Dit vervalproces herhaalt zich met een interval van 12,3 jaar.
- Voor tritium geldt dat het na 2 à 3 halveringstijden de hoeveelheid tritium al sterk is verminderd
- Het verval zal in theorie nooit stoppen, maar in de praktijk is het materiaal binnen enkele decennia veilig
Voor de meeste praktische, industriële of biologische toepassingen wordt overigens een instabiele isotoop "al" na zeven tot tien halveringstijden als voldoende vervallen beschouwd om als niet-instabiel, niet-radioactief of niet-schadelijk te worden gezien.
Sommige isotopen hebben een relatief korte halveringstijd (bijvoorbeeld tritium-3 ongeveer 12,3 jaar). Andere hebben een extreem korte halveringstijd, soms fracties van een seconde tot enkele milliseconden. Weer andere hebben een extreem lange halveringstijd (zoals uranium-238 ongeveer 4,5 miljard jaar).
Waterstof
Bron afbeelding: APOD
De Adelaarsnevel is een H II-gebied van interstellair geïoniseerd waterstof. De gigantische wolk, met een diameter van zo’n 60 lichtjaar, bestaat grotendeels uit gloeiend gas met losse protonen, doordat elektronen zijn weggeblazen door de intense ultraviolette straling van nabije jonge sterren.
De vorming van waterstofkernen
Aanvankelijk bestond het heelal uit een extreem hete, dichte mix van elementaire deeltjes, waaronder quarks en gluonen, die al snel condenseerden tot protonen en neutronen.
Naarmate het heelal afkoelde en uitdijde, begonnen protonen en neutronen te fuseren. Omdat een waterstofkern simpelweg maar één enkel proton bevat, waren deze waterstofkernen de eerste atoomkernen die ontstonden. Een neutraal waterstofatoom is samengesteld uit één proton en één elektron. het is de definitie van het element waterstof.
Elektronen konden aanvankelijk niet rond atoomkernen blijven door de extreme hitte en straling door hoog-energetische fotonen in het vroege universum. Deze fotonen hadden, door de zeer hoge temperatuur, voldoende energie om de net gevormde atomen onmiddellijk weer te ioniseren. Dit betekende dat de elektronen door de botsingen met deze energierijke fotonen constant werden losgerukt van de atoomkernen.
De isotopen van waterstof
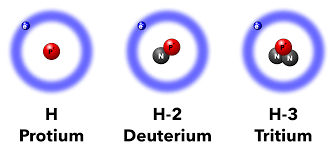
Protium
De eerste geïdentificeerde isotoop van waterstof was protium (waterstofgas of 1H), het 'gewone' waterstofatoom. Het is een stabiele isotoop die enkel uit een proton bestaat. Het is de meest voorkomende isotoop van waterstof in het universum. De talrijke hoeveelheid ervan op Aarde (de abundantie) is zeer hoog: ongeveer 99,9885% van alle waterstofatomen is protium. De termen protium en waterstofgas worden vaak door elkaar gebruikt, maar 'protium' benadrukt de specifieke atomaire samenstelling (één proton en geen neutronen), terwijl 'waterstofgas' verwijst naar de moleculaire vorm (H₂) die als brandstof wordt gebruikt.
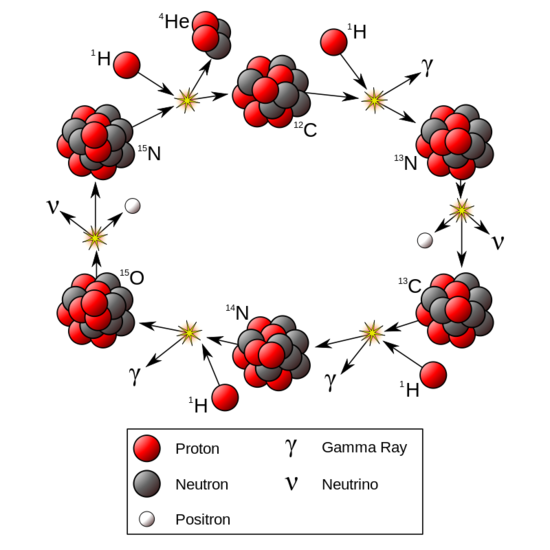
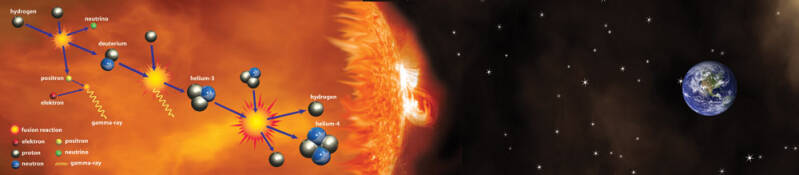
Kernfusie van protium in de kern van sterren produceert voornamelijk helium door een reeks reacties die vier waterstofkernen omzetten in één heliumkern. Dit proces staat bekend als de proton-protoncyclus en is de belangrijkste energiebron van sterren zoals de Zon.
Zowel de proton-protoncyclus (dominant in sterren zoals de Zon, met lagere massa) als de koolstof-stikstof-zuurstofcyclus (CNO-cyclus) (dominant in zwaardere sterren) zetten netto vier waterstofkernen (protium) om in één stabiele heliumkern.
In de Proton-Protoncyclus worden heliumkernen uitsluitend gevormd uit protonen.
Deze cyclus bestaat uit verschillende stappen:
- Twee protonen fuseren tot een deuteriumkern. Tijdens dit proces wordt één proton omgezet in een neutron, waarbij een positron en een neutrino vrijkomen.
- Het deuterium fuseert onmiddellijk met een ander proton om helium-3 te vormen (twee protonen en één neutron), waarbij gammastraling vrijkomt.
- Twee helium-3 kernen fuseren vervolgens tot een stabiele helium-4 kern (twee protonen en twee neutronen), waarbij twee waterstofkernen (protonen) vrijkomen die opnieuw aan de cyclus kunnen beginnen.
De CNO-cyclus (koolstof-stikstof-zuurstof-cyclus) is dominant in hetere, massievere sterren
De stappen van deze cyclus:
- Een koolstof-12 kern (12𝐶) vangt een proton (p) op en verandert in stikstof-13 (13𝑁) en een gammafoton (y).
- Stikstof-13 vervalt via beta-verval tot koolstof-13 (13𝐶) en een positron (𝑒+) en een neutrino (v)
- Koolstof-13 vangt een proton op en wordt stikstof-14 (14𝑁) en een gammafoton.
- Stikstof-14 vangt een proton op en wordt zuurstof-15 (15𝑂) en een gammafoton.
- Zuurstof-15 vervalt via beta-verval tot stikstof-15 (15𝑁) en een positron en een neutrino.
- Stikstof-15 vangt een proton op en vormt een heliumkern (alfa-deeltje, 𝛼) en koolstof-12 (12𝐶), waarmee de cyclus weer van voor af aan kan beginnen.
Bedenk trouwens dat fotonen die in de kern worden geproduceerd tijdens de proton-protoncyclus niet dezelfde zijn als de fotonen die ons oog bereiken! De extreem energierijke fotonen die direct ontstaan uit de kernfusie zijn gammastraling!! Bij elke interactie met de giga-gigantische aantallen ionen, waterstof-en heliumkernen verliezen ze wat energie en ontstaan er nieuwe fotonen. Uiteindelijk levert één hoogenergetisch foton in dit proces miljoenen fotonen met lagere energie op aan het oppervlak. Tegen de tijd dat ze het oppervlak bereiken, zijn de fotonen 'afgekoeld' tot lagere energieën, zoals ultraviolet licht, zichtbaar licht en infrarood.
Hoe lang doet een foton er eigenlijk over de rand van de Zon te bereiken?
Fotonen zijn lichtdeeltjes en als die eenmaal het oppervlak van de Zon hebben bereik kunnen ze in acht minuten bij de Aarde zijn, waardoor wij de Zon kunnen zien. De straal van de Zon is 696.000 km, dus de met de lichtsnelheid reizende fotonen zouden in theorie ruim twee seconden moeten doen over die afstand. De neutrino’s doen dat inderdaad in die tijd, omdat ze nauwelijks reageren met andere deeltjes in de zon, maar de fotonen doen er in werkelijkheid heel wat langer over. Zij reageren namelijk continue met de ionen in de kern van de Zon, de waterstof- en heliumkernen. Dat zorgt er voor dat een foton voortdurend van richting veranderd.
Op ongeveer twee derde van de afstand tot de kern bereiken de fotonen de convectiezone, waar gassen door convectie op en neer bewegen. De fotonen reizen met de gassen mee en bereiken zo uiteindelijk het oppervlak.
Deze reis van de kern naar het oppervlak kan tussen de 20.000 en 150.000 jaar duren. Wanneer wij de fotonen vervolgens acht minuten later zien, kijken we eigenlijk naar licht dat tussen de 20.000 en 150.000 jaar oud is.
Bron: Astroblogs // Brian Koberlein + NASA.
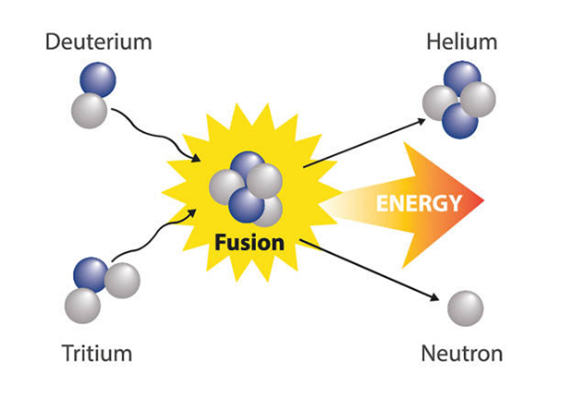
Deuterium
Deuterium, aangeduid met 2H of D, is ook een stabiele isotoop van waterstof bestaande uit één proton en één neutron. De abundantie op Aarde is laag: ongeveer 0,015% van alle waterstofatomen. Deuterium wordt gebruikt voor gespecialiseerde wetenschappelijke en nucleaire toepassingen.
Tritium
Tritium, aangeduid als 3H, is een instabiele vorm van waterstof. bestaande uit één proton en twee neutronen. De abundantie van tritium is erg laag, omdat het een instabiel isotoop is. Tritium is onder andere een brandstof voor experimentele kernfusie-installaties en wordt gebruikt in vluchtweg- en noodverlichting, zonder dat er stroom of onderhoud nodig is. Het wordt ook toegepast in situaties waar licht nodig is zonder batterijen.
De instabiliteit van tritium wordt veroorzaakt door het snelle bètaverval, waarbij een neutron wordt omgezet in een proton en tegelijkertijd een elektron (bètadeeltje) en een elektron-antineutrino (̅νe) vrijkomen. Het instabiele tritium wordt daarna omgezet in het stabiele isotoop helium-3 (3He) met een halveringstijd van ongeveer 12,3 jaar, wat betekent dat het 12,3 jaar duurt voordat de helft van de oorspronkelijke hoeveelheid tritium is vervallen in het stabiele isotoop 3He
Vorming van heliumkernen
Helium is na waterstof het meest voorkomende element in het universum en wordt gevormd in sterren als onze Zon door kernfusie van deuterium en tritium.
Het samensmelten van twee waterstofisotopen levert een heliumkern, een neutron en een enorme hoeveelheid energie op. Deze reactie vereist extreme temperaturen van ongeveer 150 miljoen °C.
Per seconde wordt ongeveer 700 miljoen ton waterstof omgezet in circa 695 miljoen ton helium. Het verschil in de massa, zo’n 4,4 miljoen ton, komt overeen met de vrijgekomen energie van 400 miljard gigajoule, per seconde dus........
Helium heeft twee stabiele isotopen: helium-3 (3He) en helium-4 (4He) De overige zes isotopen zijn zeer instabiel en hebben een extreem korte halveringstijd, waarbij 6He nog het langst in stand blijft, met een halfwaardetijd van 806,7 milliseconden.
Helium-3 (3He) is een stabiele isotoop ontstaat voornamelijk door het Bèta-min-verval van tritium. Ook bij 'n botsing van twee protonen ontstaat 3He en bij 'n botsing met helium-4 kernen.
Helium-4 (4He) is een stabiele isotoop, met een zeer hoge abundantie: ongeveer 99,99986% van alle heliumatomen is 4He. Het maakt ongeveer een kwart van de totale massa van de 'gewone' materie in het heelal uit. Het is een primordiaal atoom, wat betekent dat het is gevormd in de allereerste momenten na het ontstaan van het universum.
De grootste bron van helium-4 is het verval van zware elementen, waarbij ioniserende straling vrijkomt in de vorm van alfadeeltjes. Zo’n deeltje bestaat uit twee protonen en twee neutronen, wat precies overeenkomt met de samenstelling van helium-4.
Lithium
Lithium is het element dat voor een klein gedeelte ook gevormd werd tijdens het ontstaan van het universum. Dit atoom heeft 2 stabiele isotopen: 6Li en 7Li, waarvan de laatste het meest veelvuldig voorkomt. De overige isotopen zijn zeer onstabiel en hebben een zeer korte halveringstijd, waarbij 8Li nog het langst in stand blijft, met een halfwaardetijd van circa 840 milliseconden.
6Li wordt gebruikt als bron voor de productie van het waterstof-isotoop tritium (3H). Deze productie van tritium met lithium-6 is industrieel, met name in kernreactoren. Het proces berust op het bombarderen van lithium-6 met neutronen, wat resulteert in tritium en helium.
7Li wordt in koelsystemen van kernreactoren gebruikt, omdat het niet-radioactief is na bestraling. Lithiun-7 is ook belangrijk in batterijen vanwege de hoge energiedichtheid.
Beryllium
Beryllium is niet in significante hoeveelheden gevormd tijdens het ontstaan van het universum. De omstandigheden (temperatuur en dichtheid) waren toen niet geschikt voor de vorming van stabiele berylliumkernen. Dit element ontstaat voornamelijk door een proces dat spallatie wordt genoemd, afsplitsing. Hierbij botsen grotere atoomkernen, zoals zuurstof en stikstof (afkomstig uit kosmische straling) met elkaar of met interstellair gas, waardoor ze uiteenvallen in lichtere elementen zoals beryllium en borium
Beryllium heeft 12 isotopen, waarvan alleen 9Be stabiel is. Het wordt vooral gebruikt in materialen die zowel licht als zeer hittebestendig moeten zijn. De toepassingen van 9Be zijn daardoor vrij specifiek en komen zelden voor in alledaagse consumentenproducten, behalve indirect in elektronica of auto-onderdelen.
Straks ga ik verder met de zes cruciale elementen van het leven, nu eerst de isotopenkaart.
Het verval van de isotopen met behulp van de isotopenkaart
De zwarte 'isotopenmarkering' is het pad van stabiele isotopen.
Met behulp van de isotopenkaart kan het verval van instabiele isotopen besproken worden.
Uitleg voor het lezen van de isotopenkaart:
Tijdens Bèta-min verval beweegt de instabiele isotoop naar boven en naar links: richting de zwarte stabiele lijn.
Bèta-min verval β-
Neutron wordt omgezet in een proton
- Het aantal neutronen neemt met 1 af
- Het aantal protonen neemt met 1 toe
Tijdens Bèta-plus-verval beweegt de instabiele isotoop één naar rechts en één omlaag: richting de zwarte stabiele lijn.
Bèta-plus-verval β+
Proton wordt omgezet in een neutron
- Het aantal neutronen neemt met 1 toe
- Het aantal protonen neemt met 1 af
- Bij elektronenvangst verschuift de isotoop naar beneden en rechts op de isotopenkaart, tegenovergesteld aan bèta-min verval.
- Neutronenvangst is geen verval dat de N (neutronen) / Z (protonen)-verhouding meteen aanpast. Het is een opbouwproces, zoals in een ster. Bij neutronenvangst verschuift een isotoop op de isotopenkaart één positie naar rechts (zelfde Z, N+1). Vaak ontstaat een instabiel, neutronenrijk isotoop dat meestal stabiel wordt door bèta-min verval (schuin omhoog en links).
Het wezenlijke mechanisme van het Bèta-verval
Deze gegevens verkreeg ik m.b.v. van twee onafhankelijke AI-assistants
Quarks spelen een directe rol bij het bepalen van de eigenschappen van het element dat ontstaat tijdens verval.
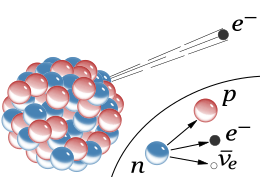
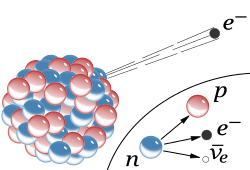
In bèta-min verval wordt een neutron in een atoomkern omgezet in een proton, een elektron en een elektron-antineutrino, waarbij de quarks een cruciale rol spelen:
Eén van de down-quarks van het neutron verandert in een upquark via de zwakke kernkracht (bemiddeld door een W-boson). Dit proces verandert de samenstelling van de kern: het neutron (udd) wordt een proton (uud), waardoor het atoomnummer stijgt en de kern stabieler wordt, terwijl een elektron en antineutrino de kern verlaten.
Mechanisme van bèta-min-verval
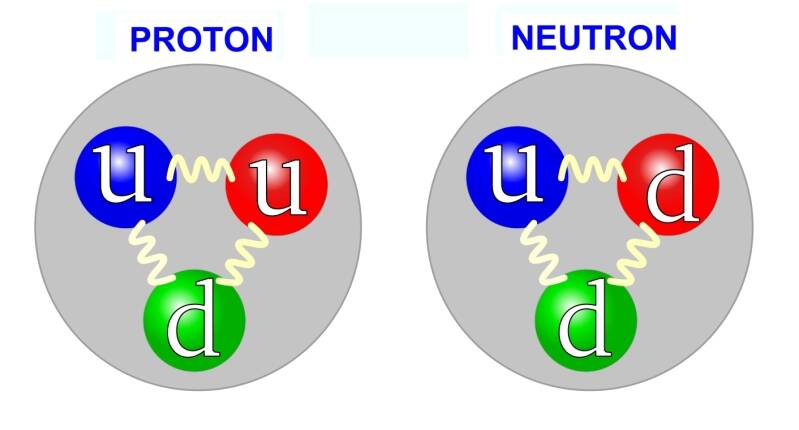
- Neutron (udd): Een neutron bestaat uit één up-quark (u) en twee down-quarks (d): quarks met lading +2/3 en -1/3
- Omzetting: Eén van de down-quarks (-1/3 lading) verandert in een up-quark (+2/3 lading).
- W-boson: Dit proces wordt mogelijk gemaakt door de zwakke kernkracht en een virtueel W⁻-boson (een 'kracht-deeltje') dat tijdelijk ontstaat en onmiddellijk vervalt.
- Proton (uud): Het resultaat is een proton (twee up-quarks en één down-quark), dat in de kern blijft.
- Emissie: De vrijgekomen energie en lading worden gecompenseerd door het uitzenden van een elektron (het bètadeeltje) en een elektron-antineutrino (antideeltje van het neutrino), die de kern verlaten.
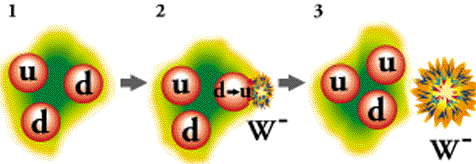
De W⁺- en W⁻-bosonen zijn elementaire deeltjes die fungeren als de overbrengers (krachtvoerende deeltjes) van de zwakke kernkracht.
Mechanisme van bèta-plus-verval
Bij een bèta-plusverval is de rol van de quarks precies omgekeerd dan die bij een bèta-minverval: een upquark verandert in een downquark. Dit β+verval vindt plaats in protonrijke kernen en wordt, net als bèta-min-verval, bemiddeld door de zwakke kernkracht.
- Quarktransformatie: Een proton bestaat uit twee up-quarks en één down-quark (uud). Tijdens het verval zendt een van de up-quarks een virtueel W⁺-boson uit en verandert daarbij in een down-quark. De quark-samenstelling wordt zo van (uud) naar (udd), wat de samenstelling van een neutron is.
- Emissie van deeltjes: Het uitgestoten virtuele W⁺-boson vervalt onmiddellijk in een positron (e+) en een elektron-neutrino (𝜈𝑒).
- Resultaat: Het oorspronkelijke proton is nu een neutron (dat in de kern blijft), en het positron en neutrino worden uitgestoten. De uitgestoten positronen vormen de bètastraling.
Het is een quantum-niveau-transformatie die de verandering van een neutron naar een proton, en omgekeerd van een proton naar een neutron teweegbrengt, wat essentieel is voor het verval en de stabiliteit van de atoomkern.
Bèta-min-verval: Neutron (udd) > Proton (uud) door down > up quark-transformatie.
Bèta-plus-verval: Proton (uud) > Neutron (udd) door up > down quark-transformatie
Naast waterstof:
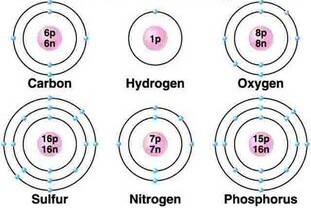
- Koolstof (C): Vormt de ruggengraat van alle organische moleculen.
- Zuurstof (O): Essentieel voor water (H₂O) en veel organische verbindingen.
- Stikstof (N): Cruciaal voor eiwitten en nucleïnezuren (DNA/RNA).
- Fosfor (P): Belangrijk voor DNA, RNA en ATP (energie).
- Zwavel (S): Vindt men in essentiële aminozuren en sommige enzymen.
Stabiele isotopen, die naast die van waterstof belangrijk zijn voor het aardse leven
Stabiele isotopen worden gebruikt om natuurlijke processen te traceren, en de oorsprong van stoffen in de atmosfeer te traceren, en om de oorsprong van stoffen in de atmosfeer te begrijpen.
Waarom deze Isotopen?
Levende systemen hebben vaak een voorkeur voor de lichtere isotopen van elementen, een verschijnsel dat isotopenfractionering wordt genoemd. Hierdoor ontstaat een andere isotoopverhouding in organismen dan in hun anorganische omgeving. Dit gebeurt omdat lichtere isotopen sneller en efficiënter reageren in chemische en biologische processen, zoals fotosynthese en metabolisme. Zonder deze isotopen zouden de chemische reacties die het leven mogelijk maken waarschijnlijk minder efficiënt verlopen.
Met deze interactieve simulatie kun je atomen bouwen, verschillende isotopen observeren en begrijpen hoe deze zich verhouden tot de atoommassa van een element.
De stabiele isotopen van de zes elementen:
- Koolstof: Het overgrote deel van de koolstof in levende organismen is koolstof-12 (¹²C). Een klein deel is koolstof-13 (¹³C), en een nog kleiner, radioactief spoor is koolstof-14 (¹⁴C), dat essentieel is voor koolstofdatering.
- Zuurstof: Zuurstof-16 (¹⁶O) is verreweg de meest voorkomende isotoop. De verhoudingen van zuurstof-17 (¹⁷O) en zuurstof-18 (¹⁸O) in water en biologisch materiaal geven inzicht in klimaatveranderingen en fysiologische processen.
- Stikstof: De dominante isotoop is stikstof-14 (¹⁴N), hoewel stikstof-15 (¹⁵N) ook aanwezig is. De verhouding tussen deze twee wordt gebruikt om voedselketens te bestuderen.
- Fosfor en Zwavel: Deze elementen bestaan in de natuur vrijwel uitsluitend uit één stabiele isotoop, respectievelijk fosfor-31 (³¹P) en zwavel-32 (³²S). Hun rol is structureel en functioneel in DNA, RNA, en eiwitten.
Koolstof
Diamant bestaat voor ongeveer 99,95% uit koolstof, dat onder extreem hoge druk en temperatuur diep in de Aarde is gekristalliseerd, waardoor het de hardste bekende natuurlijke stof is.
Diamanten vormen zich op een diepte van 150-200 km en worden door vulkanische uitbarstingen naar de oppervlakte gebracht.
Fragment van de video "Where diamonds come from"
Bron: Cabo Da Nau GemStones
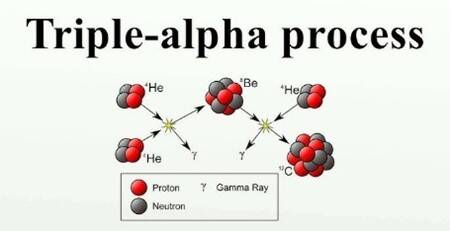
Koolstof ontstaat in sterren door het triple-alfaproces, een kernfusiereactie waarbij drie heliumkernen (alfadeeltjes) samensmelten tot één koolstofkern. Dit proces vereist extreem hoge temperaturen en dichtheden
Het proces met drievoudig-α is de kernfusie van helium tot koolstof. Twee heliumatomen botsen en vormen een onstabiele beryllium-8 atoom dat onmiddellijk vervalt tot twee alfadeeltjes (4He). Voordat dit terug kan vervallen, botst een derde α-deeltje ermee om het isotoop koolstof-12 (12C) te vormen.
Het overgrote deel van de koolstof op Aarde bestaat uit het isotoop koolstof-12 aangezien dit het meest voorkomende, stabiele isotoop van koolstof is. Er zijn twee stabiele isotopen van koolstof: 12C en 13C. Daarnaast is er een instabiel isotoop 14C dat in de atmosfeer voortdurend aangemaakt wordt door kernreacties ten gevolge van kosmische straling.
Koolstof-14 wordt veel gebruikt om archeologische vondsten te dateren. Na het afsterven van een organisme stopt de opname van koolstof-14 en begint het verval ervan, waardoor het kan worden gebruikt voor koolstofdatering om de leeftijd van organisch materiaal te bepalen. Voor het volledige proces zie verderop. Eerst hoe dit isotoop wordt aangemaakt.
Kosmische straling
Bron: David Butler howfarawayisit
Kosmische straling bestaat voornamelijk uit hoogenergetische 'primaire' protonen en atoomkernen die afkomstig zijn van buiten het zonnestelsel. Wanneer deze protonen de aardatmosfeer binnendringen, botsen ze met stikstof- en zuurstofkernen, waardoor een 'air shower' van secundaire deeltjes ontstaat
Bremstraling (van het Duitse woord 'bremsen')
Wanneer elektronen en positronen met bijna de lichtsnelheid door de atmosfeer bewegen en reageren met de elektrische velden van de atoomkernen in de lucht, worden ze afgebogen en vertraagd. Deze vertraging resulteert in het uitzenden van hoogenergetische fotonen.
Koolstofkringloop
De koolstofkringloop is het natuurlijke proces waarin het element koolstof (C) door de verschillende systemen van de aarde circuleert: de atmosfeer (lucht), de biosfeer (levende organismen), de hydrosfeer (water) en de lithosfeer (gesteenten en bodem). Dit proces is essentieel voor het leven op Aarde en het reguleren van het klimaat
Bron video: Biojuf
Koolstof-14 datering
Koolstofdatering werkt door te meten hoeveel koolstof-14 er nog over is in een niet meer levend organisme. Zolang het organisme leeft, neemt het constant koolstof-14 op via fotosynthese (bij planten) of door voedsel te eten (bij dieren), waardoor de verhouding tussen koolstof-14 en het stabiele koolstof-12 gelijk blijft aan die in de atmosfeer.
Het Proces
- Neutronenproductie: Kosmische straling uit de ruimte bombardeert voortdurend de bovenste atmosfeer, wat leidt tot cascades of 'showers' van secundaire deeltjes, waaronder neutronen.
- Transmutatie: Deze neutronen botsen met en worden ingevangen door kernen van stikstof-14, dat het meest voorkomende element in de atmosfeer is.
- Vorming van koolstof-14: Bij deze kernreactie komt een proton uit de stikstofkern vrij en wordt omgezet in een neutron in de koolstofkern Met andere woorden: een stikstof-14-kern (zeven protonen, zeven neutronen) verandert in een koolstof-14-kern (zes protonen, acht neutronen). De reactievergelijking is als volgt: 14N+n→14C+p
- Circulatie: Het nieuw gevormde koolstof-14 isotoop wordt snel geoxideerd tot het instabiele koolstofdioxide isotoop 14CO2 en verspreidt zich door de atmosfeer, waarna het via fotosynthese in levende organismen wordt opgenomen.
- De term "geoxideerd" verwijst naar de chemische oxidatietoestand van zowel de stabiele koolstofdioxide CO2, als de instabiele isotoop 14CO2. Het koolstofatoom heeft een oxidatietoestand van +4 (d.w.z. 4 elektronen erbij) en elk zuurstofatoom een oxidatietoestand van -2 (2 elektronen eraf) wat neerkomt op een totale lading van 4 + 2x-2=0 in het neutrale molecuul.
- Voor planten maakt het voor de fotosynthese niet uit welke van de twee CO2 varianten ze opnemen: zowel de stabiele, overvloedige 12CO2 als de instabiele, zeldzame en geoxideerde 14CO2 wordt op exact dezelfde manier biologisch verwerkt
Het Meetproces
Zodra een organisme sterft, stopt de opname vann koolstof-14, en begint de isotoop met een voorspelbare snelheid te vervallen via bètaverval tot stikstof-14, met een halfwaardetijd van 5730 jaar. Dit maakt de verhouding tussen koolstof-14 en de stabiele isotoop koolatof-12 een essentieel instrument voor koolstofdatering, een methode om de ouderdom van archeologische en geologische materialen te bepalen.
- Dood en Verval: Zodra het organisme sterft, stopt de opname van koolstof-14. De reeds aanwezige koolstof-14 in het weefsel begint te vervallen via bètaverval, waarbij het terugvalt naar stikstof-14. De hoeveelheid koolstof-14 neemt dus exponentieel af
- Halfwaardetijd: Dit verval gebeurt met een constante, bekende snelheid, gekenmerkt door de halfwaardetijd van koolstof-14, die ongeveer 5730 jaar Dit betekent dat na 5730 jaar precies de helft van de oorspronkelijke koolstof-14 is verdwenen.
- Meting en Berekening: Wetenschappers meten de huidige verhouding tussen koolstof-14 en koolstof-12 in bijvoorbeeld hout, bot of textiel en vergelijken deze met de bekende initiële verhouding in de atmosfeer. Door het verschil te berekenen, kunnen ze bepalen hoeveel halfwaardetijden zijn verstreken sinds het organisme stierf, en daarmee de absolute leeftijd van het monster vaststellen.
Stikstof
Stikstof is gevormd in sterren door processen van nucleosynthese, specifiek in de koolstof-stikstof-zuurstof (CNO)-cyclus, waar koolstof en zuurstof worden omgezet in stikstof bij extreem hoge temperaturen en druk.
Stikstof heeft een cruciale functie voor het leven op Aarde. Het is een fundamenteel onderdeel van aminozuren, die op hun beurt eiwitten vormen, de bouwstenen van cellen en weefsels. Bovendien is stikstof een sleutelcomponent van nucleïnezuren zoals DNA en RNA, die de genetische informatie dragen die essentieel is voor reproductie en groei.
De atmosfeer bestaat voor ongeveer 78% uit stikstofgas, dat via de stikstofkringloop wordt omgezet in bruikbare vormen door bacteriën, waardoor het aardse leven kan floreren.
De Stikstofkringloop
Gasvormig stikstof uit de lucht (N₂) moet eerst worden omgezet in door planten opneembare stikstofverbindingen.
Dit gebeurt door blikseminslag of door stikstofbindende bacteriën.
Blikseminslag kan stikstofgas (N₂) uit de lucht omzetten in ammoniak (NH₃) via een proces dat stikstoffixatie wordt genoemd.
Nitrietbacteriën zetten ammonium om in nitriet (NO₂⁻). Vervolgens zetten nitraatbacteriën dit nitriet om in nitraat, de vorm die planten kunnen opnemen.
Een andere belangrijke reactie is, dat stikstofoxiden (NOx) met waterdamp in de atmosfeer reageren om salpeterzuur (HNO₃) te vormen.
Bliksem zet atmosferische stikstof N2 om in stikstofoxiden (NOx) door de extreme hitte en energie in de lucht. Stikstofoxiden worden ook vaak geproduceerd door industriële processen. Wanneer NOx met waterdamp (H₂O) in contact komt, kunnen er verschillende reacties plaatsvinden die leiden tot de vorming van salpeterzuur.
Dit salpeterzuur valt vervolgens als zure regen of droge depositie op de grond en is dus milieubelastend.
Bodemcyclus (Microbiële Omzetting): Micro-organismen in de bodem kunnen het salpeterzuur uiteindelijk omzetten in nitriet en nitraat, wat de planten kunnen opnemen!
Stikstoffixatie (N₂ >>> NH₃/NH₄⁺)
- Gasvormig stikstof uit de lucht (N₂) moet eerst worden omgezet in door planten opneembare stikstofverbindingen, zoals ammoniak (NH₃) of ammonium (NH₄⁺).
- Dit gebeurt door blikseminslag of door stikstofbindende bacteriën in wortelknolletjes van vlinderbloemige planten.
Nitrificatie (NH₄⁺ >>> NO₃⁻)
- Ammonium (NH₄⁺) wordt in twee stappen omgezet in nitraat (NO₃⁻).
- Eerst zetten nitrietbacteriën ammonium om in nitriet (NO₂⁻). Vervolgens zetten nitraatbacteriën dit nitriet om in nitraat, de vorm die planten kunnen opnemen. Dit proces vereist zuurstof.
Assimilatie (Opname door planten)
- Planten nemen de anorganische stikstofverbindingen (nitraat en ammonium) op via hun wortels en bouwen hier organische stoffen zoals eiwitten en DNA mee.
- Planten worden vervolgens gegeten worden door dieren.
Ammonificatie (Organisch N >>> NH₃/NH₄⁺)
- Wanneer organismen (planten en dieren) doodgaan of uitwerpselen produceren, breken rottingsbacteriën en schimmels de organische stikstofverbindingen af tot ammoniak (NH₃) of ammonium (NH₄⁺).
Denitrificatie (NO₃⁻ >>> N₂)
- In zuurstofarme bodemomstandigheden zetten denitrificerende bacteriën nitraat (NO₃⁻) weer om in gasvormig stikstof (N₂) in atmosfeer.
Isotopen van stikstof
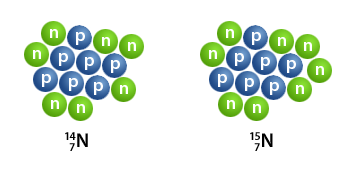
Stikstof heeft twee stabiele isotopen, stikstof-14 (¹⁴N) en stikstof-15 (¹⁵N), waarbij ¹⁴N het meest voorkomt en ¹⁵N zeldzamer is. Daarnaast zijn er 'n dertiental instabiele isotopen, die allemaal snel vervallen.
- Stikstof-14 Dit is de meest voorkomende isotoop, goed voor ongeveer 99,62% van alle natuurlijke stikstof. Het is een van de weinige stabiele nucliden (atomen met een specifiek aantal protonen en neutronen in de kern), dat zowel een oneven aantal protonen (zeven) als neutronen (zeven) heeft. Stikstof-14 is verantwoordelijk voor de stabiele atmosfeer van de Aarde.
- Stikstof-15 Deze isotoop is veel zeldzamer, met een natuurlijk voorkomende hoeveelheid (abundantie) van ongeveer 0,38%. Wordt gebruikt in onderzoek om biochemische processen te traceren.
- De andere isotopen van stikstof zijn instabiel en vervallen razendsnel, met een korte tot zeer korte halveringstijd.
Over stikstof nog het volgende:
Het stikstofprobleem
Zoals je weet bestaat de atmosfeer voor ongeveer 78% uit stikstof en voor de resterende 22% uit zuurstof, koolstofdioxide en een beetje argon.
Het probleem zit niet in het stikstofgas dat overal om ons heen aanwezig is en waar iets mis mee zou zijn, maar in de reactieve stikstofverbindingen die in te grote hoeveelheden in de natuur en in de lucht terechtkomen. Deze stoffen verstoren de natuurlijke kringloop, omdat ecosystemen en de atmosfeer niet zijn aangepast aan de enorme toevoer ervan door menselijke activiteiten zoals landbouw, verkeer en industrie.
Naast het eerder genoemde natuurlijke proces van bliksemontlading, worden de probleem-veroorzakende bronnen van reactief stikstof door menselijke activiteiten veroorzaakt:
- Landbouw: Grootste bron van ammoniak, via mest en kunstmest.
- Verkeer en industrie: Verontrustende bronnen van stikstofoxiden.
- Energieopwekking: Verbranding van fossiele brandstoffen leidt ook tot NOx-uitstoot.
De twee meest relevante verbindingen in de context van milieuvervuiling zijn:
- Stikstofoxiden (NOx): Ontstaan voornamelijk bij de verbranding van fossiele brandstoffen door verkeer, industrie en energiecentrales.
- Ammoniak (NH₃): De belangrijkste bron hiervan is de landbouw, met name dierlijke mest en kunstmes
Zuurstof
Op deze afbeelding wordt het proces van fotosynthese weergegeven. Planten gebruiken zonlicht, water en koolstofdioxide om zuurstof te produceren.
Fotodissociatie is het proces waarbij een foton van de zon een atmosferisch molecuul of atoom, in dit geval waterdamp, opbreekt in nieuwe atomaire of moleculaire onderdelen. Het speelt een belangrijke rol in de chemie van planetaire atmosferen.
Meer dan 2,4 miljard jaar geleden onderging de Aarde een van de meest dramatische veranderingen in haar geschiedenis: het Grote Oxidatie-Event een keerpunt dat de atmosfeer voor het eerst met zuurstof vulde.
- De aanwezigheid van zeer reactieve vrije zuurstof, die organische stoffen kan oxideren en daardoor giftig was voor de toen grotendeels zuurstofarme biosfeer, zorgde destijds voor het uitsterven van een zeer groot aantal vroege levensvormen op Aarde. Voor deze organismen was het een ware "Zuurstofcrisis". Maar voor andere organismen werd de weg vrij gemaakt voor op zuurstof gebaseerd leven en complexe meercelligheid. Het werd een “Zuurstofrevolutie” die een ingrijpende verandering teweeg bracht in de chemie van de planeet, wat onder meer leidde tot de vorming van de beschermende ozonlaag.
The Great Oxidation Event: How cyanobacteria changed life...
Hoe kunnen kleine cyanobacteriën de voorbode zijn van een verandering van zo'n omvang? Van alle biochemische uitvindingen die het leven zou kunnen bedenken, moet het vermogen van cyanobacteriën om water als brandstof voor zuurstofproductie te gebruiken tot een van de meest ingenieuze behoren.
Ozon (O₃) beschermt de Aarde hoog in de atmosfeer, maar is op leefniveau een schadelijke verontreinigende stof.
De ozonlaag bevindt zich in de stratosfeer, zo’n 15 tot 40 kilometer boven het aardoppervlak. In deze ijle lucht is de ozon wijd verspreid, waardoor de ‘laag’ in feite tientallen kilometers dik is. Als je alle ozon in de atmosfeer zou samenpersen tot één laag op zeeniveau, zou die maar zo’n 3 millimeter dik zijn.
Isotopen van zuurstof
Zuurstof heeft 17 isotopen. Naast de meest voorkomende zuurstofisotoop 16O komen er nog twee andere stabiele isotopen voor: 17O en 18O. Er zijn 14 instabiele isotopen bekend met halveringstijden van minder dan drie minuten.
De verhoudingen van ¹⁷O en ¹⁸O in water geven inzicht in klimaatverandering
Fractionering tijdens Verdamping
- Verdampingsproces: Wanneer water verdampt, worden de isotopen niet gelijkmatig verdeeld. 16O verdampt gemakkelijker dan 18O vanwege zijn lichtere massa ( 16O heeft 2 neutronen minder: 8 protonen + 8 neutronen = massa 16 // 8 protonen + 10 neutronen = massa 18 ). Dit betekent dat als water verdampt, het waterdamp dat vrijkomt een relatief hogere verhouding heeft van 16O.
- Gevolg voor Neerslag: De neerslag die uit deze waterdamp ontstaat, bevat daardoor relatief meer 18O en 17O, vooral in warme klimaten waar verdamping sterker is.
Verhouding en Klimaat
- Wetenschappers kunnen de verhoudingen van 17O en 18O in ijs, sedimenten en andere waterbronnen analyseren. Deze verhoudingen veranderen met klimaatverandering.
- In koudere perioden is er minder verdamping en een grotere opbouw van ijs, wat leidt tot lagere 17O en 18O waarden in het smeltwater. Omgekeerd, in warmere periodes is er meer verdamping, wat resulteert in hogere 17O en 18O waarden.
Bepalen van temperatuur en neerslagpatronen
- Door de relatie tussen de isotopen en temperatuur of neerslag te meten, kunnen wetenschappers de klimaatcondities analyseren.
Fosfor
Fosfor is essentieel voor het leven op Aarde. Het is een belangrijk bestanddeel van DNA, RNA, ATP (energie), celmembranen en botten. Fosfor is naast stikstof (en kalium) ook een belangrijke voedingsstof voor planten om te groeien. Fosfor wordt bijna uitsluitend aangetroffen in de aardkorst in gebonden vorm, als fosfaat dat een verbinding is van fosfor en zuurstof.
De belangrijkste bronnen van het element op Aarde zijn fosfaatgesteenten, die voornamelijk bestaan uit het mineraal apatiet. Momenteel is er sprake van bezorgdheid over de overexploitatie van fosfaatgesteente, omdat het een eindige grondstof is die essentieel is voor de wereldwijde voedselvoorziening. Er wordt roofbouw gepleegd in de context van de niet-duurzame winning van het fosfaat.
'Fosforcrisis'
Nog dieper in de shit: na het stikstofprobleem wacht ons ‘fosfogeddon’
een dreigende ecologische en landbouwkundige crisis.

Nauru is een eilandstaat in de Stille Oceaan (Grote Oceaan), een van de kleinste republieken ter wereld, gelegen in Micronesië, ten noordoosten van Australië, bekend om zijn fosfaatwinning en de unieke koraalformaties.

Nauru was historisch gezien bijna uitsluitend een fosfaatmijn, wat het land in de tweede helft van de 20e eeuw tot een van de rijkste landen ter wereld maakte per hoofd van de bevolking. Echter, de primaire fosfaatreserves waren tegen het begin van de 21e eeuw vrijwel uitgeput.
Isotopen van fosfor
Fosfor heeft één stabiele isotoop: fosfor-31 (31P). De overige 22 isotopen zijn onstabiel en hebben een relatief korte halveringstijd (de meeste minder dan een seconde). In de natuur is fosfor-31 de meest voorkomende isotoop, die ongeveer 99,99% van alle natuurlijk voorkomende fosfor uitmaakt.
Fosfor-31 ontstaat zowel bij het radioactief verval van silicium-31 als van zwavel-31.
Fosfor-31(31P) ontstaat zowel bij het radioactief verval van silicium-31 (31Si) en zwavel-31 (31S)
- Tijdens bèta-minverval verschuift de instabiele isotoop 31Si diagonaal omhoog: één omhoog, één naar links om stabiel te worden
- Tijdens bèta-plusverval verschuift een instabiele isotoop 31S diagonaal omlaag: één omlaag, één naar rechts om stabiel te worden.
Zwavel
Zwavel ontstaat specifiek via het alfa-proces in zwaardere sterren, waarbij heliumkernen (alfadeeltjes) door fusie worden toegevoegd aan zwaardere elementen.
Het alpha-proces, ook wel alfaladder genoemd, is een reeks opeenvolgende fusies waarbij een bestaande zware kern, beginnend bij koolstof, een extra heliumkern opneemt.
Vanaf de 'onderste tree' 12C+4He→16O
12C is het totaal massagetal 12 → 6 protonen en 6 neutronen.
4He is het massagetal 4 → 2 protonen en 2 neutronen.
16O is het totaal massagetal 16 → 8 protonen en 8 neutronen.
C6 betekent in dit schema dat koolstof het atoomnummer 6 heeft
He2 betekent dat helium het atoomnummer 2 heeft
Ne10 betekent dat neon het atoomnummer 10 heeft
Zwavel heeft atoomnummer 16
De reeks stappen binnen massieve sterren die uiteindelijk tot zwavel leiden, verloopt als volgt:
- Koolstof-12 (12C) vangt een alfadeeltje (4He) in en wordt Zuurstof-16 (16O)
- Zuurstof-16 vangt een alfadeeltje in en wordt Neon-20.
- Neon-20 vangt een alfadeeltje in en wordt Magnesium-24.
- Magnesium-24 vangt een alfadeeltje in en wordt Silicium-28.
- Silicium-28 vangt een alfadeeltje in en wordt uiteindelijke Zwavel-32.
Deze stappen vormen de alfaladder van koolstof tot aan zwavel (en verder), waarbij elk element door het absorberen van alfadeeltjes in het volgende element verandert. Dit proces illustreert hoe zware elementen ontstaan en uiteindelijk deel uitmaken van de nucleosynthese in sterren.
Hierbij ontstaan elementen met een even atoomnummer. Deze even nummering van isotopen is ook terug te vinden in de zwarte lijn van de isotopenkaart.
Waardoor ontstaan in stellaire processen elementen met een even atoomnummer?
De voornaamste redenen hiervoor zijn:
- Zwaardere elementen dan helium worden gevormd door de opeenvolgende fusie van heliumkernen met 2 protonen en 2 neutronen. Elke fusie voegt dus twee protonen toe aan de kern, wat resulteert in elementen met een even atoomnummer (bijv. koolstof (atoomnummer Z =6), zuurstof (Z=8), neon (Z=10), magnesium (Z=12), enz.).
- Kernen met een even aantal protonen (en vaak ook een even aantal neutronen) zijn over het algemeen stabieler dan kernen met een oneven aantal
Zwavel komt in vulkanische gebieden naar de oppervlakte door verschillende geologische en chemische processen. Hier is een overzicht van hoe dit gebeurt:
1. Vulkanische Activiteit
- Magma en Gasvorming: In de diepte vormt zich magma, dat verschillende gassen bevat, waaronder zwavelverbindingen (zoals waterstofsulfide, H₂S).
- Drukopbouw: Tijdens vulkanische activiteit kan de druk in de magmakamer toenemen, waardoor gassen gedwongen worden om naar boven te stijgen, samen met het gesmolten gesteente.
2. Hydrothermale Activiteit
- Verhitte Waterbronnen: Wanneer magma in contact komt met grondwater, kan dit water verwarmen en omgezet worden in stoom en andere gassen, waaronder zwavel.
- Gassubductie: De opwarming kan leiden tot de oplossing van zwavel in het water, waardoor het naar de oppervlakte kan stijgen via hydrothermale bronnen.
3. Oplossing en Neerslag
- Chemische Reacties: Bij het ontstaan van vulkanische atmosferen en in sporen waar vulkanische gassen ontsnappen, kunnen zwavelverbindingen zoals H₂S oxideren tot zwavel (S) of zwavelzuur (H₂SO₄).
- Afzetting: Wanneer de gassen in een koeler omgeving komen of met water reageren, kan zwavel neerslaan of als mineraal afzetten.
4. Vulkanische Zwavelvelden
- Geothermisch Activiteit: In sommige vulkanische gebieden ontstaan zwavelvelden dankzij de aanvoer van zwavelrijke gassen. Deze velden kunnen zichtbaar worden als gele of witte afzettingen van elementaire zwavel.
Zwavelbronnen Krysuvik in IJsland.
Voor mij waren het geen verstikkende walmen met typische geuren van 'rotte eieren'.
Toen ik in deze warme vochtige mistflarden liep, overweldigde mij de gedachte, dat ik de elementaire uitademing van dit stukje IJsland aan het inademen was.
De meest voorkomende zwavelverbindingen die vrijkomen bij vulkanische activiteit zijn:
- Waterstofsulfide (H₂S)
- Een kleurloos gas met een sterke geur naar rotte eieren. Het komt vaak voor in vulkanische dampen en hydrothermale systemen.
- Zwaveldioxide (SO₂)
- Een kleurloos gas dat sterk zuur is. Het ontstaat bij de verbranding van zwavel en kan bijdragen aan zure regen.
- Elementaire zwavel (S)
- Zwavel kan als een vast mineraal neerslaan in vulkanische gebieden, vooral op plaatsen waar vulkanische gassen condensatie ondergaan en afkoelen.
- Zwavelzuur (H₂SO₄)
- Dit kan ontstaan door de oxidatie van zwavelverbindingen in de lucht, vooral wanneer SO₂ in contact komt met waterdamp.
- Thiosulfaat (S₂O₃²⁻)
- Soms gevormd in zwavelrijke systemen als een tussenproduct bij de oxidatie van sulfide-mineralen.
- Sulfide-mineralen
- Zoals pyriet (FeS₂) en galena (PbS), die vrijkomen tijdens vulkanische processen.
IJzer
IJzermeteorieten komen voort uit de resten van de protoplanetaire schijf waaruit ons zonnestelsel zo’n 4,6 miljard jaar geleden is gevormd.
De meeste ijzermeteorieten zijn afkomstig van kleine planetesimalen, die de bouwstenen van grotere planeten waren. Deze planetesimalen konden gedeeltelijk smelten, waardoor gescheiden lagen van metalen en silicaten ontstonden.
Tijdens de smeltprocessen konden zwaardere metalen, zoals ijzer en nikkel, naar de kern van de planeten migreren.
56Fe heeft 26 protonen en 30 neutronen en is één van de vier stabiele isotopen van ijzer. De abundantie van 56Fe bedraagt 91,754% en is daarmee de meest voorkomende isotoop van ijzer.
56Fe ontstaat zowel door β+ verval van kobalt-56 (56Co) als door β- verval van mangaan-56 (56Mn)
Tijdens β+ verval beweegt het instabiele isotoop 56CO
één naar rechts en één omlaag om het stabiele 56Fe te worden.
Tijdens β- verval beweegt het instabiele isotoop 56Mn
één omhoog en één naar links om het stabiele 56Fe te worden.
IJzer (Fe) is een cruciaal element in het universum, niet alleen vanwege zijn rol in de levenscyclus van sterren, maar ook door de impact die het heeft op de chemische samenstelling van sterrenstelsels en planeten.
In het universum komt ijzer naar verhouding tot zijn hoog atoomnummer (26) nog relatief veel voor omdat het 't laatste element is dat door kernfusie door nucleosynthese wordt geproduceerd in superzware sterren.
Zoals je weet ondergaan zware sterren kernfusie tijdens hun levenscyclus, waarbij aanvankelijk de lichtere elementen samensmelten tot zwaardere. Dit begint met waterstof, dat helium produceert, en gaat door met het fusieproces waarbij uiteindelijk elementen als koolstof, zuurstof, en uiteindelijk ijzer ontstaan.
IJzer is het laatste element dat efficiënt door kernfusie kan worden geproduceerd in sterren. Dit komt doordat de kernbindingsenergie per nucleon het hoogst is bij ijzer. Kernbindingsenergie is de totale energie die vereist is om de nucleonen (protonen en neutronen) binnen een kern te verbinden. Hoe hoger de kernbindingsenergie, hoe stabieler de kern is. Deze neemt toe tot elementen vlak voor ijzer (zoals in koolstof, zuurstof en silicium), waar het een hoog niveau bereikt. Bij ijzer en z'n isotopen is de kernbindingsenergie per nucleon dus het hoogst. de energie die vrijkomt bij kernfusie van waterstof tot helium / van helium tot koolstof enz. wordt geproduceerd doordat de bindingsenergie steeds verbroken wordt totdat ijzer is bereikt. Bij het element ijzer is de bindingsenergie dus het hoogst.
De energie die vrijkomt bij kernfusie van waterstof tot helium / van helium tot koolstof enz. wordt geproduceerd doordat de bindingsenergie steeds verbroken wordt totdat ijzer is bereikt. De bindingsenergie van ijzer in sterren is dus het hoogst. Straks leg ik uit hoe dit proces overgaat in een supernova.
Supernova's en de oorsprong van ijzer
Aan het begin van deze verdieping zie je een video van de supernova die de Krabnevel heeft gevormd. Tijdens deze indrukwekkende explosie ontstaan door de extreme hitte en druk alle elementen zwaarder dan ijzer, inclusief ijzer zelf, die daarna de interstellaire ruimte in worden geslingerd.
Kernfusie in gewone sterren stopt bij ijzer. Tijdens een supernova ontstaan zwaardere elementen dan ijzer, zoals goud, lood en uranium. Waarom juist goud, lood en uranium? Door de gigantische energie die vrijkomt bij een supernova-explosie en de schokgolf die door de ster raast, vindt een eerder besproken proces plaats: het snelle neutronenvangstproces (r-proces). Ongeveer de helft van de elementen zwaarder dan ijzer, waaronder een deel van het element zilver, ontstaat echter via het s-proces.
De zwaarste elementen zoals goud, lood en uranium, worden dus gevormd door het r-proces tijdens catastrofale gebeurtenissen zoals supernova-explosies, of..........door de fusie van neutronensterren.
Naast supernova's zijn er ook kilonova's
Kilonova’s zijn duizend maal krachtiger dan nova's, maar nog altijd zo’n 10 tot 100 keer minder krachtig dan supernova’s.
Uit recent onderzoek blijkt dat dit andere type gebeurtenis misschien wel een nog grotere, of zelfs dé belangrijkste, bron is van de zwaarste elementen en hun isotopen in het heelal.
- Kilonova's zijn samensmeltingen van neutronensterren. De samensmelting van twee neutronensterren creëert nog extremere en neutronenrijkere omstandigheden dan een supernova-explosie. Waarnemingen van de kilonova GW170817 hebben dit bevestigd en lieten zien dat er enorme hoeveelheden van deze zware elementen worden geproduceerd en de ruimte in geslingerd.
Het signaal van kilonova GW 170817 kwam van de spectaculaire samensmelting van twee neutronensterren in de nabije sterrenstelsel NGC 4993, ongeveer 130 miljoen lichtjaar van de Aarde.
Specifieke zware elementen gevormd in kilonova's:
- Edelmetalen: Goud, platina en zilver.
- Lanthanoïden, die samen met scandium en yttrium, bekend staan als de zeldzame aardmetalen.
- Actinoïden..
- Radioactieve elementen: zoals uranium en thorium.
Het sterrenstelsel NGC 4993 bevindt zich ongeveer 130 miljoen lichtjaar van de Aarde. Op 17 augustus 2017 werden zwaartekrachtsgolven gedetecteerd van een botsing van neutronensterren binnen dit sterrenstelsel. Het evenement resulteerde ook in een lichtflits die een kilonova wordt genoemd, die links boven in het galactische centrum zichtbaar is op deze afbeelding van de Hubble-ruimtetelescoop.
Bron: NASA Science
Maar hoe ontstaan neutronensterren eigenlijk?
Neutronensterren ontstaan als de kern van een ster van tussen de 8 en 25 keer de massa van onze Zon, instort na een supernova of een kilonova. De zwaartekracht perst alles samen tot een bol van slechts 10 tot 25 kilometer breed, maar met de massa van 1,5 keer de Zon.
Bij nóg zwaardere sterren (meer dan 25-30 zonsmassa's), onstaan Zwarte gaten.
De zwaartekracht is hier zo overweldigend dat de materie tot een punt met oneindige dichtheid wordt geperst, dat zelfs licht niet meer weet te ontsnappen.......
Dit wil ik uitleggen in mijn volgende Verdieping